ABSTRACT
Dental implant surgery usually takes over 6 to 9 months, with 3 to 6 months specifically allocated for osseointegration between the implant and the surrounding bone. To expedite this process, we developed an innovative hybrid composite structure and a bioreactor. This hybrid structure features an assembly-type implant combined with a 3D-printed polycaprolactone (PCL) scaffold. The implant was redesigned in a modular format to enable the insertion of a scaffold between components, facilitating bone-to-bone contact instead of metal-to-bone contact, which enhances osseointegration. The PCL scaffold was coated with polydopamine (PDA) to improve cell adhesion. Additionally, a bioink that mimics bone composition, consisting of type I collagen and nano-hydroxyapatite (nHA), was incorporated into the scaffold. To support cell maturation within the scaffold, we developed a hydrostatic pressure bioreactor system that applies uniform compressive stress to complex 3D structures. We assessed cell viability in the scaffold using the CCK-8 assay, and SEM imaging confirmed the effectiveness of the PDA coating. Furthermore, we evaluated osteogenic differentiation through ALP activity and calcium quantification assays under both static and dynamic stimulation conditions.
-
KEYWORDS: Tissue engineering, Bioreactor, Scaffold, Dental implant, Hydrostatic pressure
-
KEYWORDS: 조직공학, 바이오리액터, 인공지지체, 치과용 임플란트, 정수압
1. 서론
고령화 사회의 진입과 더불어 치과 질환의 유병률이 증가하고 있으며, 이에 따라 치과용 의료기기, 특히 임플란트 시장의 규모도 꾸준히 확대되고 있다. 치과 임플란트 수술 기간은 6-9개월 이상이며, 수술 기간 중 골과 임플란트 간의 골유착을 위해 3-6개월의 상당한 시간이 소요된다
[1]. 현재, 조직공학 분야 내에서는 이를 개선하고자 골 재생을 촉진하기 위한 다양한 인공지지체(Scaffold)가 개발되고 있다. 인공지지체는 세포가 부착할 수 있는 환경을 제공하는 구조체이다. 현재 개발된 인공지지체의 경우, 생체적합성, 생분해성을 가진 소재로 제작되어 세포 부착과 조직 형성을 유도하는 환경을 제공한다
[2].
하지만, 이러한 구조체만으로는 세포의 분화 및 조직화를 효과적으로 유도하는데 한계가 있다. 이를 보완하기 위해서, 조직화를 돕기 위한 생체 내 환경을 모사한 바이오리액터(Bioreactor) 시스템을 활용한다. 바이오리액터 시스템의 역할은 실제 생체 내에 발생되는 다양한 자극을 모방한 환경 및 세포가 안정적으로 배양될 수 있도록 pH, 영양분, 이산화탄소 등이 조절 가능한 환경을 제공한다
[3].
또한, 바이오리액터 시스템은 자극의 유형에 따라 기계적(압축, 전단, 인장 등), 전기적(전자기장, 전압 전류 등), 화학적(성장인자, pH 등) 자극을 기반으로 다양한 형태로 분류된다. 특히, 기계적 자극 기반의 바이오리액터 시스템의 경우에는 물리적 자극에 민감한 골 조직 재생에 핵심적인 역할을 한다. 실제로 골조직 내에서는 물리적 자극이 많이 발생하기 때문에 이를 모방한 압축, 인장, 전단응력 등 다양한 형태의 바이오리액터 시스템들이 개발되고 있다
[3].
본 연구에서는 이를 활용하여 골유착 기간을 단축시킬 수 있는 하이브리드 복합 구조체와 바이오리액터 시스템을 개발하고자 한다.
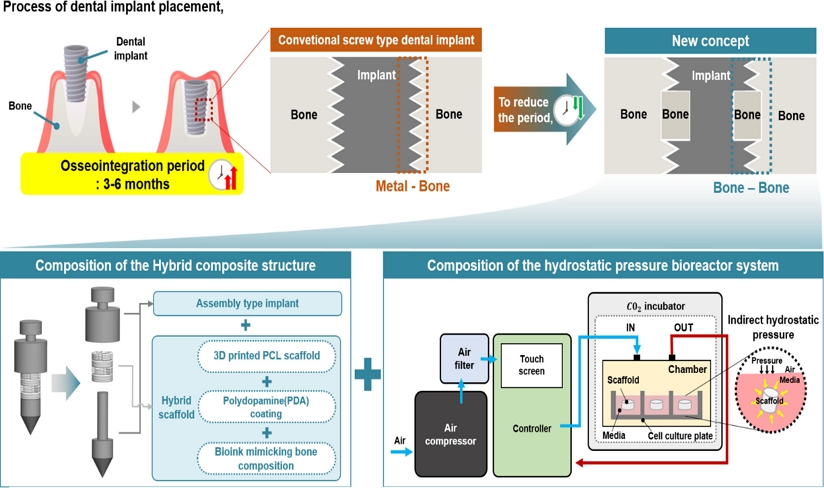
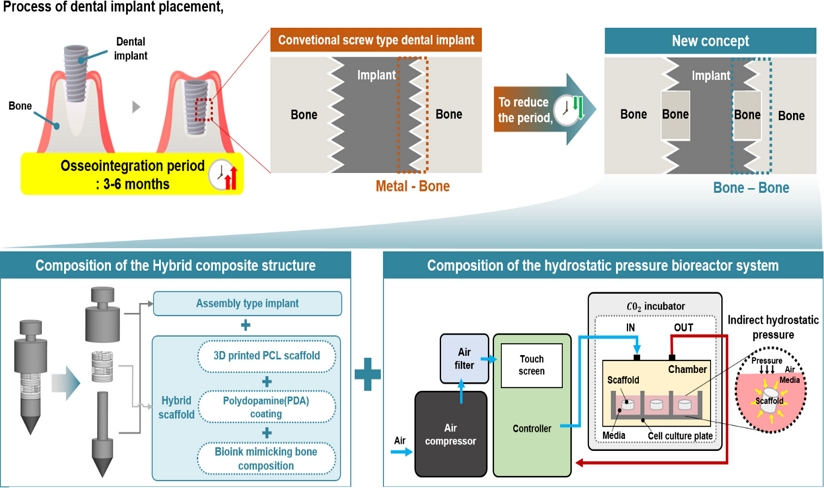
Fig. 1을 보면, 본 연구에서 개발한 복합구조체는 조립식 임플란트와 하이브리드 인공지지체로 구성되어있다. 이는 삽입 직후 빠른 골유착을 유도하기 위한 전략으로, 구조체 중간에 골 재생에 유리한 인공지지체를 삽입할 수 있도록 조립식 임플란트 사이에 하이브리드 인공지지체를 탑재하는 방식으로 설계하였다. 하이브리드 인공지지체는 3D 프린팅 기반의 PCL (Polycaprolactone) 인공지지체로 구성되며, 해당 소재는 가공용이성, 생분해성, 생체적합성 등의 장점이 있어 인공지지체로 적합한 특성을 갖습니다. 그러나 PCL은 표면이 소수성을 띠기 때문에, 세포가 선호하는 친수성으로 표면 개질이 필요하다. 이에 따라 세포 접착력 향상을 위해 PDA (Polydopamine) 코팅을 실시하였고, 추가적으로 골 구성성분을 모방한 바이오잉크를 탑재했다. 이를 통해 금속과 기존 주변 치조골이 접촉되는게 아닌 인공지지체를 통해 재생된 골과 기존 주변 치조골이 접촉될 수 있도록 골유착에 유리한 복합구조체를 설계하고 제작하였다. 또한, 탑재된 인공지지체 내의 세포의 성숙화를 돕기 위해서 다방향에서 압축 자극이 가능하여 복잡한 구조체에도 전반적으로 압축 자극을 가할 수 있는 정수압 바이오리액터 시스템을 개발하였다.
Fig. 1 Schematic illustration of the concept
2. 재료 및 실험 방법
2.1 하이브리드 복합구조체 설계 및 제작
2.1.1 조립형 임플란트 설계 및 제작
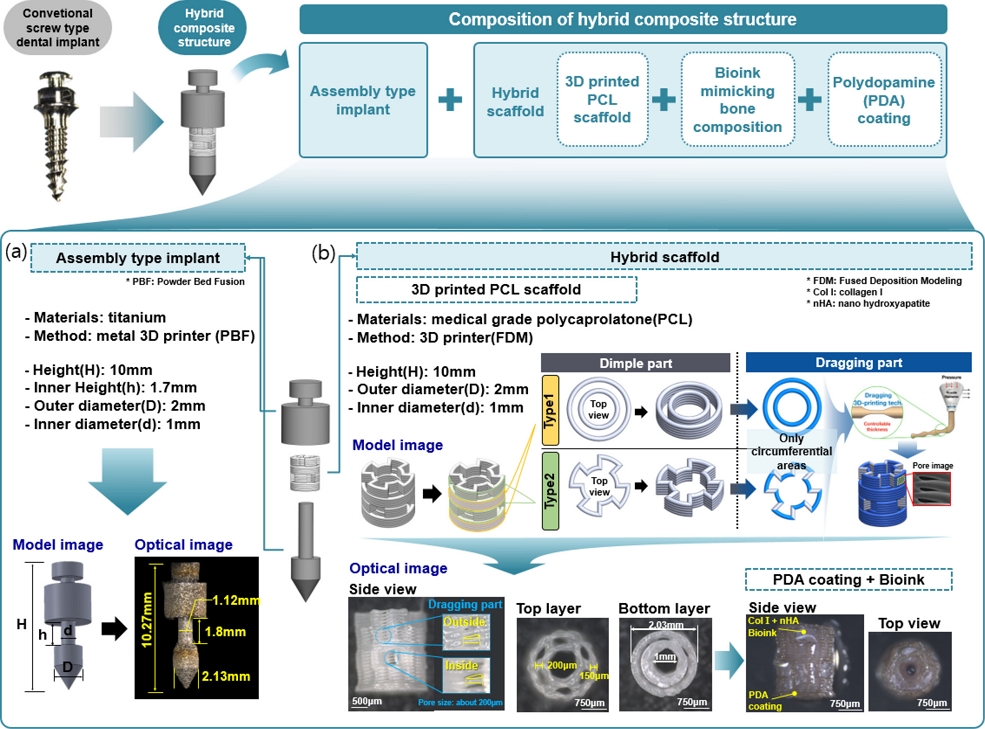
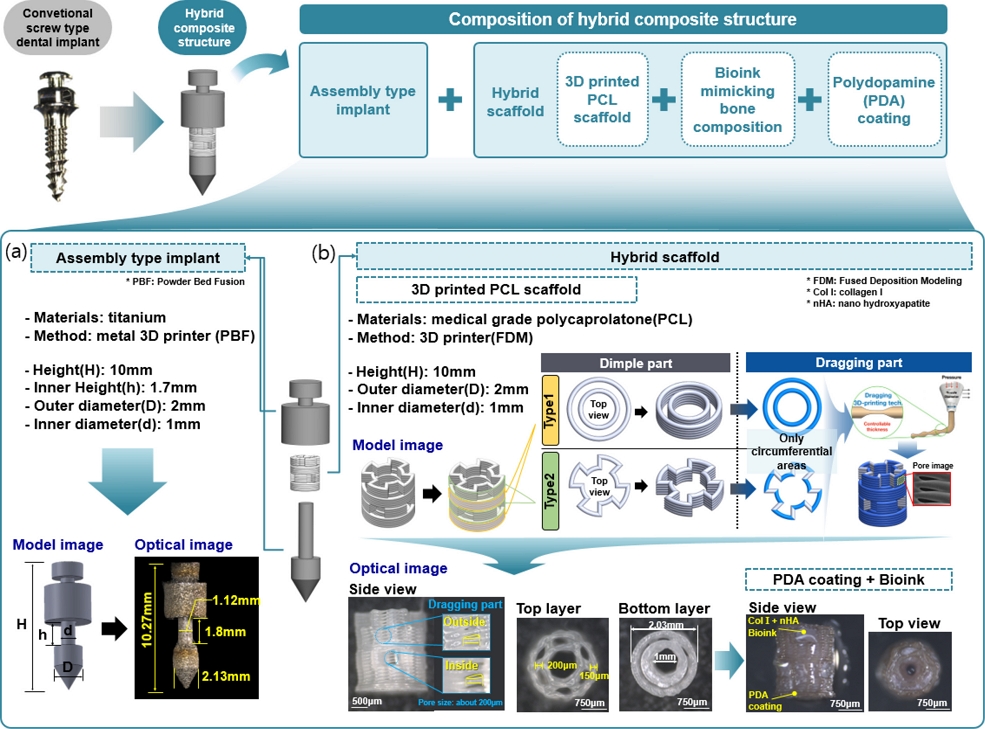
하이브리드 복합구조체는 조립형 임플란트와 하이브리드 인공지지체로 구성되어 있으며,
Fig. 2(a)은 조립형 임플란트의 모델링 및 실제 제작된 모습을 나타낸다. 조립형 임플란트는 향후에 동물 실험 결과와 비교하기 위해서 Rat용 임플란트와 유사한 크기로 설계하였다. 또한,
Fig. 2(b)를 보면 임플란트 중간에 인공지지체가 탑재될 수 있도록 조립식 형태로 설계하였으며 PBF (Powder Bed Fusion) 방식의 금속 3D 프린터(DAVID 1.0, Merain Company, Korea)를 사용하여 티타늄 소재로 제작하였다.
Fig. 2Composition of the hybrid composite structure: (a) Assembly type implant and (b) Hybrid scaffold
2.1.2 하이브리드 인공지지체 설계 및 제작
하이브리드 인공지지체는 3D 프린팅 기술 기반의 PCL 인공지지체와 P DA 코팅 그리고 골 구성성분을 모방한 바이오잉크로 구성되어 있다. 3D 프린팅 기술 기반의 P CL 인공지지체는 조립형 임플란트 중간에 탑재되며 3D 프린터를 이용하여 의료용 PCL 소재(C209, Evonik, Germany)로 제작하였으며, 이는 생체적합성 및 생분해성의 특징을 가져 세포 독성이 없으면서 체내에서 분해된다. PCL 인공지지체의 구조는 Dimple Part와 Dragging Part로 구성되어 있다.
Fig. 2(b)를 보면 Dimple Part의 경우에는 Type 1과 2의 형태가 차례대로 반복적으로 쌓아 올린 구조이다. 또한, Dragging Part의 경우에는 인공지지체의 모든 원주에 해당되는 부분에 작은 기공을 형성하였으며, 기공은 이동 속도를 순간적으로 증가시켜 토출된 Strand의 두께를 얇게 만들어 기공을 생성하는 이전 연구에서 개발한 방법(Dragging Tech)을 사용하였다
[4]. 이 기술을 통해 모든 원주 부분에 기공의 크기는 약 200 μm 크기를 가진다.
제작된 PCL 인공지지체는 소재 특성상 소수성 표면을 가지기 때문에 이를 보완하고자 세포 부착력을 향상시키기 위해 PDA코팅을 진행하였다. PDA는 생체적합성이면서 표면 접착력이 강해 인공지지체 표면에 세포 부착력 향상을 위해 조직공학 관련된 많은 연구에 사용되고 있다
[5,
6].
제작된 인공지지체의 표면 개질을 위해 Dopamine (Dopamine Hydrochloride, Sigma-Aldrich, USA)를 10 mM Tris-HCl 완충용액(pH 8.5)에 용해하여, 최종 농도가 2 mg/ml가 되도록 폴리도파민 용액을 준비하였다.
준비된 도파민 용액에 PCL 인공지지체를 첨가한 후, 실온에서 60 rpm으로 12시간 동안 교반하였다
[5].
PDA가 코팅된 PCL 인공지지체(PCL-DA)을 회수하여 증류수로 3회 세척하고, 실온에서 1일간 건조하여 사용하였다.
바이오 잉크는 실제 골조직 구성성분을 모방하였으며, 골 조직은 세포와 ECM으로 구성되어있다. ECM은 크게 유기질부분과 무기질 부분으로 나뉜다. 유기질 부분에는 주로 1형 콜라겐(골의 30% 중량을 차지함)으로 이루어진 단백질 섬유들이 많이 존재하며, 무기질 부분은 대부분 미네랄로 구성되어 있으며, Nano Hydroxyapatite(골의 약 70% 중량을 차지함)가 주요 구성요소로 Collagen I 과 nHA의 무게 비율은 약 1 : 2로 구성되어 있다
[7]. 이 비율을 바탕으로 바이오 잉크를 제조하기 위하여, nHA (Nano Hydroxyapatite, Sigma-Aldrich, USA) 분말을 세포배양액에 첨가한 뒤, Pellet Pestle (KIMBLE
® PELLET PESTLE
® Cordless Motor, DWK Life Sciences, Germany)을 사용하여 약 4
oC의 조건에서 균질하게 혼합하여 최종 농도 6% (w/v)의 HA 용액을 제조하였다. 이후, 준비된 6% HA 용액에 3% Collagen I (TendoRegen
®, Ubiosis, Korea)을 혼합하여, Collagen I과 nHA의 최종 무게 비율이 1 : 2가 되도록 바이오 잉크를 제작하였다.
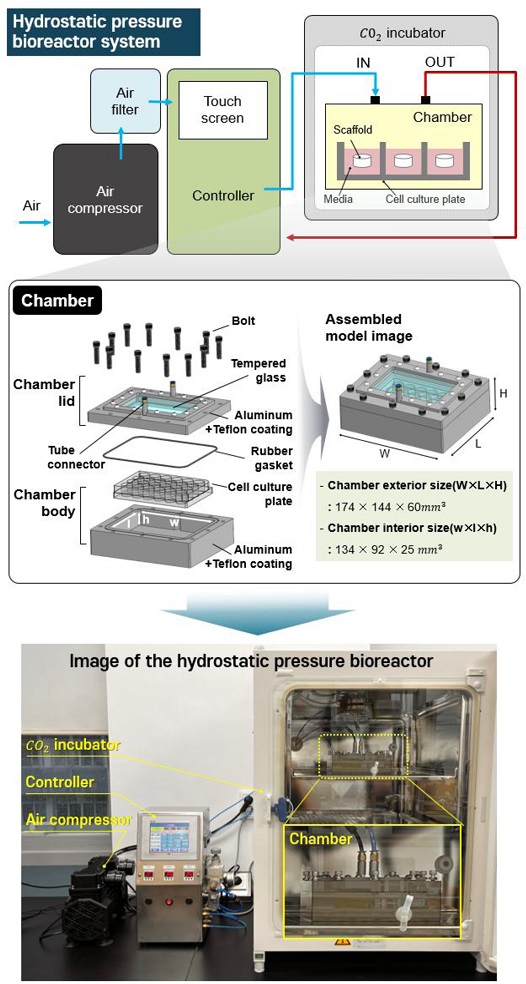
Fig. 3은 정수압 바이오리액터 시스템의 구성 및 실제 구축 이미지를 나타낸다. 본 연구에서 개발된 정수압 바이오리액터 시스템은 에어 컴프레셔(DC660, KOLAVO, Korea), 에어필터(PF2000, TPC Mechatronics, Korea), 컨트롤러(LS-XBM, MPLUSTEC, Korea), 챔버로 구성되어 있으며 효율적인 인큐베이터 내에 효율적인 공간활용을 위해 챔버 부분만 상용화된 Cell Culture Plate에 맞춰 최대한 소형화하여 인큐베이터에 들어갈 수 있도록 설계하였다. 에어 컴프레셔는 최대 0.5 MPa까지 압력을 가할 수 있으며, 컨트롤러는 최대 3개의 챔버까지 연결하여 작동가능하다. 또한, 압력 값, 작동/휴지 시간을 터치스크린을 통해 값을 입력하여 조절할 수 있으며, 실시간 압력 값 현황을 확인할 수 있다. 본 시스템의 작동원리는 에어 컴프리셔로 공기를 흡입하면 에어필터를 거쳐 컨트롤러를 통해 설정된 압력 값 및 작동/휴지 시간만큼 챔버 내에 압력 자극이 가해지게되는 원리이며, 챔버에 압력 자극이 가해지게 되면 챔버 내부에 들어있는 Cell Culture Plate에 있는 배양액에 압력이 전달되면서 배양액 내에 들어있는 인공지지체에 전반적으로 압력이 가해지게 된다.
Fig. 3Composition of the hydrostatic pressure bioreactor system
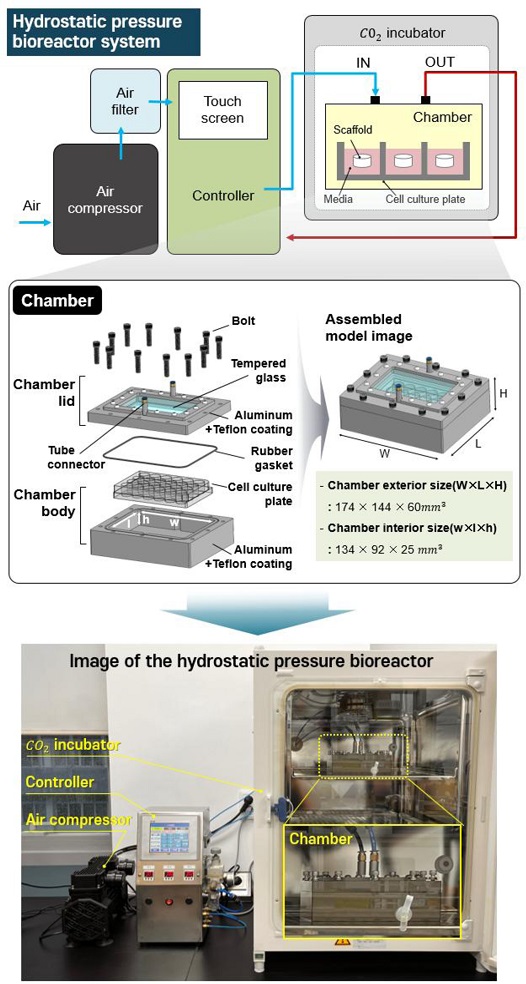
챔버의 전체 부피는 174 × 144 × 60 mm3이며, 챔버는 Lid와 Body로 나뉜다. Lid의 경우에는 알루미늄 및 강화유리 소재로 제작되었으며, 외부에서도 인공지지체를 볼 수 있도록 알루미늄판 중간에 강화유리를 삽입하였으며 공기의 출입을 위해 호스를 결착할 수 있는 커넥터 부분도 장착하였다. Body의 경우에는 알루미늄 소재를 사용하였으며 상용화된 Cell Culture Plate 크기에 맞춰 내부 공간을 134 × 92 × 25 mm3 가지도록 설계하였다. 또한, 공기가 누출되지 않도록 윗부분에 홈을 파서 고무 링을 넣을 수 있도록 설계하였다. 또한, 챔버에서 알루미늄 소재에 해당되는 부분은 추가로 테프론 코팅을 하여 내부 세척 및 고압 증기 멸균에 용이하도록 제작했다.
Fig. 4Contact angle(CA) results

2.3 세포 실험 및 형태학적 분석
2.3.1 세포 배양 및 세포 분화
본 연구에서는 쥐 유래 전골아세포인 MC3T3-E1세포(CRL-2593, ATCC, USA)를 사용했다. MC3T3-E1 세포 증식을 위해 10% Fetal Bovine Serum (FBS, Sigma-Aldrich, USA)와 1%의 Penicillin (100 μg/mL) 포함된 Alpha-MEM (α-MEM) 배양액을 사용하여 37oC, 5% (v/v) CO2 조건에서 배양하였다. 배양액은 2일에 한번 교체하였으며, 세포 분화 평가할 때에는 배양액에 L-Ascorbic Acid (50 μgml−1, Sigma-Aldrich, USA)와 β-Glycerophosphate (10 mM, Sigma-Aldrich, USA)를 첨가하여 골분화를 유도했다.
2.3.2 세포 씨딩(Seeding) 방법
하이브리드 인공지지체 내에 세포를 씨딩 하기 위해, 앞서 제조한 바이오 잉크에 쥐 유래 전골아세포인 MC3T3-E1 세포를 혼합하여 최종 세포 농도가 1 × 105 cells/5ul가 되도록 준비하였다. 세포와 바이오 잉크는 1 mL 주사기(HENKE-JECT®, Henke-Sass Wolf GmbH, Germany)를 사용하여 균질하게 혼합하였다. 이후, 하이브리드 인공지지체를 세포 함유 바이오 잉크에 침지한 다음, 원심분리기(Fleta 5, Hanil Scientific, Korea)를 이용하여 1,200 rpm에서 10초간 원심분리하여 인공지지체 내부에 바이오 잉크가 효과적으로 주입되도록 하였다. 이러한 과정을 통해 인공지지체 1개당 최종적으로 1 × 105 cells이 탑재되도록 하였다.
2.3.3 접촉각 분석
인공지지체의 세포 부착력 향상을 위해 PDA 코팅을 진행했으며, PDA 코팅 여부를 확인하기 위해서 접촉각 측정을 통해 인공지지체 표면의 친수성을 평가하였다. 먼저, 접촉각 측정을 위해 간단하게 가로 7 mm × 세로 7 mm 크기의 2차원 형태의 드래깅 멤브레인(Dragging Membrane)에 P DA 코팅을 실시한 시료(PCL-PDA)와 비코팅 시료(PCL) 두 종류를 준비하였다. 그 다음, 접촉각 측정 장비(SmartDrop Plus HS, FEMTOBIOMED, Korea)를 이용하여 시료 위에 증류수, PBS (Phosphate Buffered Saline, Gibco, USA), 증식배양액을 5 uL씩 떨어트린 후, 액적 형성 후 3초 이내에 접촉각을 측정하였다. 모든 시료는 서로 다른 시료로 5회 반복 측정하였으며, 평균값 결과를 정리하였다. 측정 시 멤브레인은 유리 슬라이드 위에 평평하게 고정하여 안정적인 측정을 통해 인공지지체의 표면 개질 정도를 확인하였다.
2.3.4 Scanning Electron Microscopy Image 분석
Collagen I과 nHA가 혼합된 바이오 잉크의 내부 미세구조를 확인하기 위하여 주사전자현미경(Scanning Electron Microscopy, SEM) 분석을 수행하였다. 바이오 잉크를 -80oC의 저온 냉동고(TSE320D, Thermo Fisher Scientific, USA)에서 24시간 동안 냉동한 후, 동결건조기(LYU-8608, OPERON, Korea)를 이용하여 48시간 동안 동결건조 하였다. 이후 시료 표면에 백금(Pt) 코팅을 실시한 뒤, SEM (S-4800, Hitachi, Japan)을 사용하여 내부 미세구조를 관찰하였다.
또한, PDA코팅 효과를 확인하기 위하여 가로 7 mm × 세로 7 mm × 두께 0.15 mm 크기의 2차원 형태의 드래깅 멤브레인에 PDA 코팅을 실시한 시료(PCL-PDA)와 비코팅 시료(PCL) 두 종류를 준비하였다. 각 시료에 MC3T3-E1 세포를 시료당 5 × 104 cells 농도로 씨딩하고, 동일한 배양 조건 하에서 1, 3, 7일간 배양하였다. 배양 종료 후, 시료를 4% Paraformaldehyde (Biosesang, Korea)에 1일간 고정한 뒤 증류수로 세척하였고, 단계적 에탄올 탈수(50%, 70%, 90%, 100%, 각 10분)를 수행하였다. 탈수된 시료는 저온 냉동 보관 후 동결건조를 통해 건조하였으며, 이후 백금(Pt) 코팅을 거쳐 SEM 분석을 통해 세포의 부착 및 분포를 확인하였다.
2.3.5 CCK-8 분석
하이브리드 인공지지체 내에 세포의 생존률을 분석하기 위해 서 D-Plus™ CCK Cell Viability Assay Kit (CCK-8, Dongin Biotech, Korea)을 이용하여 분석하였다. 배양된지 1일, 3일째에 CCK-8 solution을 넣고 4시간 동안 37oC, 5% CO2 인큐베이터에서 실험하였다. 배양 후, 96 Well Plate에 100 μL씩 분주한 다음 마이크로플레이트 리더기(Epoch™, BioTek, USA)를 이용하여 450 nm에서 흡광도를 측정했다.
2.3.6 ALP Activity 분석
하이브리드 인공지지체의 압축 자극에 의한 골 세포의 분화에 대한 영향을 확인하기 위해서 ALP Activity를 수행하였다. 먼저, 세포의 안정화를 유도하기 위해서 2일 동안 증식 배양액에서 사전 배양을 진행했다. 이후 분화 배양액으로 교체하고 37oC, 5% CO2 조건에서 7일 동안 배양하였다.
그 다음, 인공지지체를 24 Well Culture Plate에 넣고 TRACP & ALP Assay Kit (MK301; Takara, Japan)를 제조사의 지침에 따라 사용하여 분석을 진행했다. 각 Well에 150 μL의 Substrate Solution과 Extraction Solution을 넣고 각각 37oC에서 45분 동안 반응시켰다. 그 후, 150 μL의 Stop Solution을 첨가하여 405 nm에서 마이크로플레이트 리더기(EpochTM, BioTek, USA)를 사용하여 측정했다.
2.3.7 칼슘 정량 분석
칼슘 침착량은 골세포의 분화 및 성숙을 나타내는 또다른 대표적인 지표로 동적 자극에 의한 세포의 분화 및 성숙에 대한 영향을 확인하기 위해서 분석을 진행했다. 마찬가지로 분석을 진행하기 전에 세포의 안정화를 유도하기 위해 2일 동안 사전 배양을 진행했다. 세포 내 칼슘 침착량을 정량하기 위해서 Calcium Assay Kit (DICA-500, BioAssay Systems, USA)를 사용하였으며, 제조사의 지침에 따라 수행하였다. 인공지지체를 24 Well Culture Plate에 넣고 PBS로 세척한 후, 0.6N HCL (Hydrochloric Acid, DAEJUNG, KOREA)을 4oC에 4시간을 넣어놓고 칼슘을 추출하는 과정을 거친다. 그 다음, 추출된 용액 중 5 μL를 96-well에 분주하고 Reagent A와 B를 1 : 1로 혼합한 시약을 200 μL를 각 Well에 첨가하였다. 실온에서 3분간 반응시킨 뒤, 612 nm에서 마이크로플레이트 리더기(EpochTM, BioTek, USA)로 흡광도를 측정하여 칼슘 농도를 정량화하였다.
2.3.8 통계학적 분석
하이브리드 인공지지체의 증식 및 분화 평가 실험 후, 압축 자극에 따른 세포의 증식 및 분화의 차이를 비교 분석하기 위해서 이원 배치 분산 분석(Two-way ANOVA)을 이용하였다. 통계학적 분석을 위해서 각 실험군별로 3개의 샘플을 이용하였으며, 유의 수준은 95%로 설정하였다.
3. 실험 결과 및 고찰
3.1 바이오잉크의 내부 형상 분석
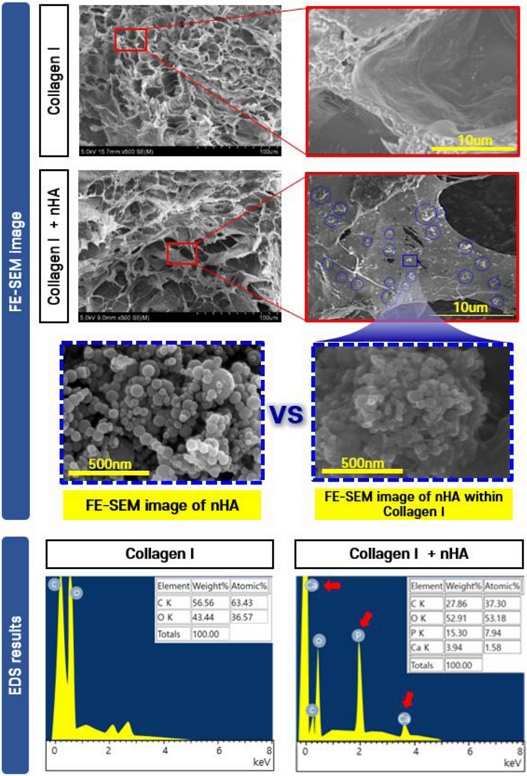
제작된 바이오잉크의 내부 구조를 확인하기 위해 FE-SEM 이미지 분석 및 EDS 분석을 수행하였다. 먼저, Collagen I과 nHA의 혼합 여부를 확인하기 위해, Collagen I 단독군과의 FE-SEM 이미지를 비교하였다. 그 결과,
Fig. 5에서 파란색 원으로 표시된 영역들을 보면 미세한 구형 입자들이 넓게 분포되어 있는 것이 관찰되었으며, 이는 nHA로 추정된다. 이들 입자를 확대하여, Collagen I과 혼합되기 전의 nHA 입자 형상과 비교한 결과, 유사한 구형의 표면 형상을 유지하고 있음을 확인하였다.
Fig. 5SEM image and EDS analysis results of the bioink
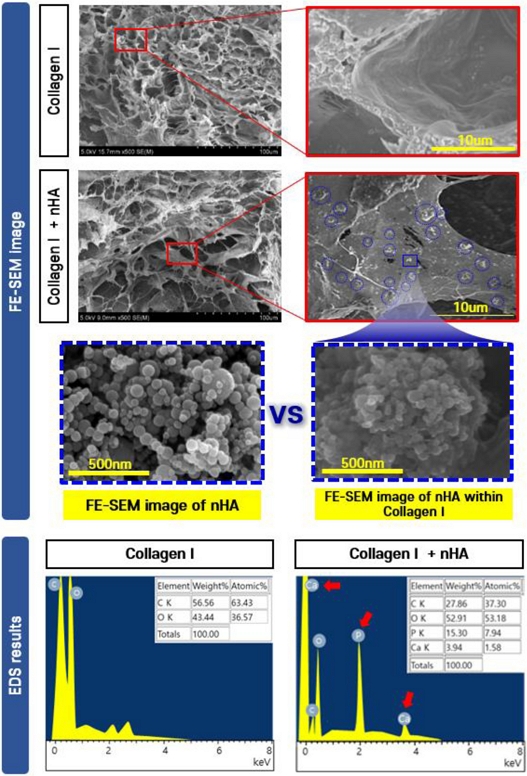
또한, 해당 입자의 성분을 분석하기 위해 EDS 분석을 실시하였다. 그 결과, 대조군인 Collagen I에서는 C (56.56 wt%)와 O (43.44 wt%)가 주요 원소로 검출되었으며, Ca와 P는 검출되지 않았다. 반면, 실험군에서는 C (27.86 wt%) 및 O (52.91 wt%) 외에도 P (15.30 wt%)와 Ca (3.94 wt%)가 검출되었으며, 이는 바이오잉크 내부에 인산칼슘계 무기물인 nHA가 성공적으로 혼합되었음을 시사한다.
3.2 PDA 코팅 효과 확인
먼저, PDA 코팅 여부를 확인하기 위해서 접촉각 장비를 통해 각 시료의 표면에DW, PBS, 증식 배양액을 떨어트려 접촉각을 측정했다. 그 결과, PCL 시료의 접촉각은 증류수, PBS, 증식 배양액 순으로 약85
o, 72
o, 89
o이며, PCL-PDA 시료의 경우에는 약 15
o, 13
o, 12
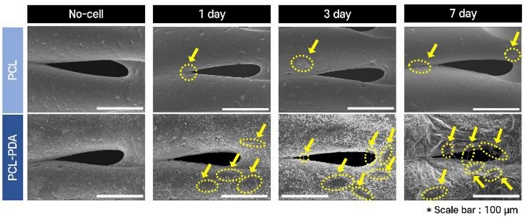
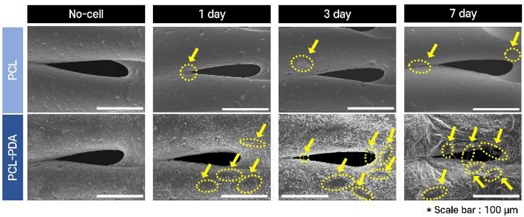
o로 측정되었다. PCL-PDA 시료는 PCL의 시료에 비해 접촉각이 증류수, PBS, 증식 배양액 순으로 각각 약 82%, 82%, 86% 감소하였다. 이는 PDA 코팅을 하게 되면 소수성에서 친수성으로 표면이 개질되었음을 나타낸다. 그 다음, PDA의 표면 개질 효과를 확인하기 위해서 SEM Image를 통해 PDA 코팅 전, 후의 인공지지체의 표면을 비교했다. 1, 3, 7일의 PDA 코팅 전, 후를 비교한 결과,
Fig. 6에서 3일 이후부터 PCL에 비해 PCL-PDA 시료에 많은 세포가 부착되었음을 확인하였다. 이는 세포의 부착력이 향상되었음을 나타내며 PDA의 세포 부착력 효과가 있음을 확인했다.
Fig. 6SEM image results of cell attachment
3.3 하이브리드 인공지지체 내의 세포 증식 및 동적 자극에 따른 세포 분화 결과
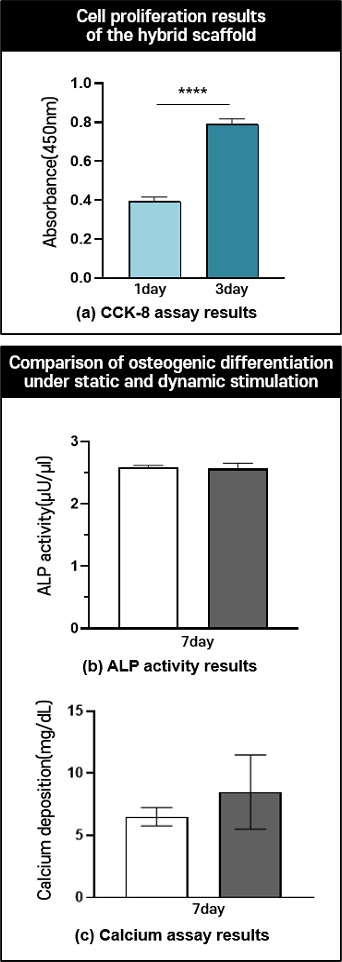
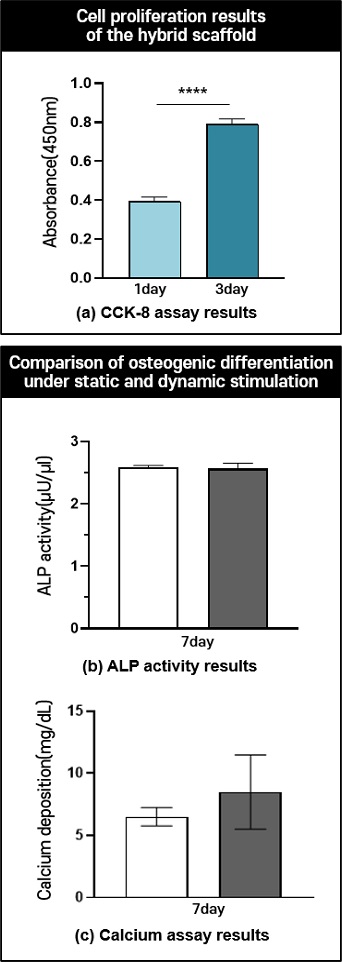
세포의 성숙화를 위해 바이오리액터 시스템에 적용하기 전에 하이브리드 인공지지체 내에 세포가 배양될 수 있는 환경인지 확인하기 위해서 짧게 3일동안 배양하여 CCK-8 분석을 통해 세포 증식을 평가하였다. 그 결과,
Fig. 7(a)을 보면 1일차에 비해 3일차에 약 2배 이상의 흡광도 값이 측정되었으며 이를 통해 세포가 하이브리드 인공지지체 내에서 세포 증식이 가능한 환경임을 뜻한다. 그 다음, 바이오리액터 시스템의 성숙화를 확인하기 위해서 자극을 주지 않은 정적 배양된 인공지지체와 정수압 자극을 주는 동적 자극 환경에서 배양된 인공지지체를 ALP Activity와 Calcium Assay 분석을 통해 비교 분석하였다. 동적 자극 조건은 현재 골 재생 관련해서 정수압 바이오리액터 시스템에서 가장 많이 사용되는 조건(0.27 MPa, 1 Hz, 1 hr/day)으로 실험을 진행했다
[8-
11].
Figs. 7(b) 및
7(c)를 보면 총 7일 동안 분석하였으며, ALP Activity 결과에서는 유의미한 차이가 없었다. 또한, Calcium Assay 결과에서는 정적 자극에 비해 동적 자극을 가한 인공지지체가 증가하는 경향임을 확인했다. 이는 전반적으로 세포 분화 기간이 7일로 짧아 아직 분화가 많이 진행되지 않는 것으로 판단된다.
Fig. 7Evaluation of cell proliferation in the hybrid scaffold and Osteogenic differentiation under dynamic stimulation
4. 결론
본 연구에서는 치과 임플란트의 골유착을 향상시키기 위해서 기존의 임플란트의 스크류 형태와 다른 새로운 형태의 복합구조체를 개발하였다. 본 복합구조체는 조립식 형태의 임플란트와 3D 프린팅 기반의 구조체에 PDA 코팅과 골 구성성분을 모방한 바이오잉크가 탑재된 하이브리드 인공지지체가 결합된 구조체이다. 또한, 복합구조체의 골유착 향상을 돕기 위해서 동적 자극을 가할 수 있는 정수압 형태 기반의 바이오리액터 시스템을 개발하였다.
복합구조체 하이브리드 인공지지체는 PDA 코팅이 세포의 접착력이 향상됨을 확인하였으며, 인공지지체 내에서 세포 증식이 가능한 환경인지도 확인하였다. 또한, 바이오리액터 시스템을 통해 정적 자극과 동적 자극에 대한 세포 분화 결과를 비교하였으나 세포 분화기간이 짧아 유의한 차이가 크게 나타나지 않은 것으로 사료된다. 향후 2주 이상의 장기 배양을 통해 동적 자극에 따른 세포 분화 양상을 정량적으로 평가할 필요가 있으며, 개발한 구조체 표면와 임상용 임플란트 표면 간의 초기 세포 부착 및 골 형성 양상도 비교할 예정이다.
ACKNOWLEDGMENTS
본 연구는 대한민국 정부 산업통상자원부 및 방위사업청 재원으로 민군협력진흥원에서 수행하는 민군기술협력사업의 연구비 지원으로 수행되었습니다(No. 22-CM-BR-12).
REFERENCES
- 1.
Suzuki, S., Kobayashi, H., Ogawa, T., (2013), Implant stability change and osseointegration speed of immediately loaded photofunctionalized implants, Implant Dentistry, 22(5), 481-490.
10.1097/ID.0b013e31829deb62
- 2.
Asghari, F., Samiei, M., Adibkia, K., Akbarzadeh, A., Davaran, S., (2017), Biodegradable and biocompatible polymers for tissue engineering application: A review, Artificial Cells, Nanomedicine, and Biotechnology, 45(2), 185-192.
10.3109/21691401.2016.1146731
- 3.
Darshna, Kumar, R., Srivastava, P., Chandra, P, (2023), Bioengineering of bone tissues using bioreactors for modulation of mechano-sensitivity in bone, Biotechnology and Genetic Engineering Reviews, 39(2), 688-728.
10.1080/02648725.2022.2162249
- 4.
Jeong, H.-J., Nam, H., Kim, J.-S., Cho, S., Park, H.-H., Cho, Y.-S., Jeon, H., Jang, J., Lee, S.-J., (2024), Dragging 3D printing technique controls pore sizes of tissue engineered blood vessels to induce spontaneous cellular assembly, Bioactive Materials, 31, 590-602.
10.1016/j.bioactmat.2023.07.021
- 5.
Kao, C. T., Lin, C. C., Chen, Y. W., Yeh, C. H., Fang, H. Y., & Shie, M. Y., (2015), Poly (dopamine) coating of 3D printed poly (lactic acid) scaffolds for bone tissue engineering, Materials Science and Engineering: C, 56, 165-173.
10.1016/j.msec.2015.06.028
- 6.
Wang, J., Cui, Y., Zhang, B., Sun, S., Xu, H., Yao, M., Wu, D., Wang, Y., (2024), Polydopamine-modified functional materials promote bone regeneration, Materials & Design, 238, 112655.
10.1016/j.matdes.2024.112655
- 7.
Hayrapetyan, A., Bongio, M., Leeuwenburgh, S. C., Jansen, J. A., van den Beucken, J. J., (2016), Effect of nano-HA/collagen composite hydrogels on osteogenic behavior of mesenchymal stromal cells, Stem Cell Reviews and Reports, 12(3), 352-364.
10.1007/s12015-016-9644-x
- 8.
Shen, H.-X., Liu, J.-Z., Yan, X.-Q., Yang, H.-N., Hu, S.-Q., Yan, X.-L., Xu, T., El Haj, A. J., Yang, Y., Lü, L.-X., (2022), Hydrostatic pressure stimulates the osteogenesis and angiogenesis of MSCs/HUVECs co-culture on porous PLGA scaffolds, Colloids and Surfaces B: Biointerfaces, 213, 112419.
10.1016/j.colsurfb.2022.112419
- 9.
Latour, M. L., Pelling, A. E., (2022), Mechanosensitive osteogenesis on native cellulose scaffolds for bone tissue engineering, Journal of Biomechanics, 135, 111030.
10.1016/j.jbiomech.2022.111030
- 10.
Naqvi, S. M., Panadero Pérez, J. A., Kumar, V., Verbruggen, A. S., McNamara, L. M., (2020), A novel 3D osteoblast and osteocyte model revealing changes in mineralization and pro-osteoclastogenic paracrine signaling during estrogen deficiency, Frontiers in Bioengineering and Biotechnology, 8, 601.
10.3389/fbioe.2020.00601
- 11.
Reinwald, Y., El Haj, A. J., (2018), Hydrostatic pressure in combination with topographical cues affects the fate of bone marrow‐derived human mesenchymal stem cells for bone tissue regeneration, Journal of Biomedical Materials Research Part A, 106(3), 629-640.
10.1002/jbm.a.36267
Biography
- Eun Chae Kim
Ph.D. candidate in the Department of Mechanical Engineering, Wonkwang University. Her research interest is tissue engineering.
- Jun-Kyu Kang
Master’s student in the Department of Chemical Engineering, Wonkwang University. His research interest is chemical engineering.
- Hun-Jin Jeong
Associate Research Scientist in the College of Dental Medicine, Columbia University Irving Medical Center. His research interest is tissue engineering.
- So-Jung Gwak
Professor in the Department of Chemical Engineering, Wonkwang University. Her research interest is nerve tissue regeneration.
- Seung-Jae Lee
Professor in the Department of Mechanical Engineering, Wonkwang University. His research interest is tissue engineering.