ABSTRACT
Bioengineered skeletal muscle constructs that replicate the architectural, metabolic, and contractile characteristics of native tissue are becoming essential platforms for disease modeling and advancing regenerative medicine. The creation of these constructs relies heavily on cell-mediated gel compaction, a crucial process for facilitating tissue maturation. To ensure myotube alignment, muscle cell-laden hydrogels are typically embedded in 3D-printed molds with anchor structures. However, structural detachment or rupture often occurs during culture, which undermines the stability and functional differentiation of the engineered tissue. To address these challenges, we developed an improved anchor-type mold through a series of structural optimizations. We first compared two anchor geometries—linear and mushroom-shaped pillars—within rectangular frames, finding that the mushroom-shaped design provided better structural retention. However, the rectangular frames led to excessive gel compaction, causing detachment and disrupting cellular alignment, especially in central regions. To alleviate these issues, we introduced a dumbbell-shaped mold with a narrowed midsection to better distribute mechanical stress. This new mold effectively promoted aligned myotube formation, long-term construct maintenance, and functional maturation. Our findings underscore the benefits of structurally optimized molds in creating stable engineered muscle, with significant implications for regenerative therapies and preclinical testing platforms.
-
KEYWORDS: Anchor-type mold, Engineered muscle, 3D printing, Cell-mediated gel compaction
-
KEYWORDS: 앵커형 몰드, 인공 골격근, 3D 프린팅, 세포 기반 겔 수축
1. 서론
골격근(Skeletal Muscle)은 인체 전체 체중의 약 40%를 차지하며 운동뿐 아니라 대사 조절 및 체온 항상성, 자세 유지 등 생리학적으로 매우 중요한 기능을 수행한다
[1]. 이러한 골격근 조직은 대사 기능과 관련이 깊기 때문에 만성 질환 및 유전성 질환 등 다양한 원인으로 손상될 수 있으며 결과적으로 삶의 질저하와 기능 상실로 이어진다
[2]. 이러한 문제를 해결하기 위해 손상된 근육을 대체하거나 재생할 수 있는 인공 골격근(Engineered Skeletal Muscle)의 개발이 활발히 이루어지고 있으며 이는 질병 모델링, 재생의학, 약물 스크리닝 등 다양한 응용 분야에서 각광 받고 있다
[3].
기능적인 골격근 조직의 제작은 세포 기반 겔 수축(Cell-mediated Gel Compaction), 근섬유(Myotube)의 정렬 유도 및 형성, 기계적 안정성을 위한 골격근 조직 제작용 몰드의 설계가 핵심 요소로 작용한다. 몰드 구조의 형상과 앵커 위치 등 미세환경적 요소는 조직 안정성, 근섬유의 정렬, 근육 세포의 수축 정도 등과 직결된다. 이러한 변수들은 PDMS (Polydimethylsiloxane) 및 3D 프린팅 기반 몰드를 통해 정밀하게 제어할 수 있다
[4]. 최근에는 근섬유 정렬을 안정적으로 유도하고 구조체를 효과적으로 고정하기 위해 앵커 구조(Anchor Structure)가 포함된 골격근 조직 제작용 앵커형 몰드를 이용하는 연구가 활발히 이루어지고 있다
[5]. 그러나 기존 몰드의 경우, 골격근 조직의 수축이 빠르게 발생하면서 몰드로부터 탈락되거나 파열되는 현상이 빈번하게 나타난다. 이는 골격근 조직의 구조적 안정성과 기능적 성숙을 저해하는 주요 원인으로 작용할 수 있다
[4]. 따라서 골격근 조직 제작용 앵커형 몰드의 구조적 요인이 골격근 조직에 미치는 영향에 대한 정량적 연구의 필요성이 크다.
따라서 본 연구에서 골격근 조직 구조체의 안정성과 장기 배양 가능성을 개선하기 위해 몰드 디자인을 최적화하였다. 골격근 조직 제작을 위해 세포 분화 및 부착, 조직 재생 유도에 효과적이고 생체적합성이 뛰어난 탈세포화 세포외기질(dECM: Decellularized Extracellular Matrix)을 사용하였다
[6-
8]. 최근에는 dECM을 하이드로겔화하여 다양한 조직 재생 연구에 활용하고 있으며 특히 골격근 재생에 최적의 생체 재료로 주목받고 있다
[9]. 또한 골격근 관련 연구에서 주로 활용되는 C2C12 Mouse Skeletal Muscle Cell Line을 사용하였다
[10]. 우선 골격근 구조체의 탈락 현상을 방지하기 위해 앵커 형태를 디자인하여 골격근 조직의 고정에 미치는 영향을 평가하였다. 이어서 기존 직사각형 몰드의 문제를 해결하고자 중간부 너비가 다른 덤벨형 몰드를 3가지 그룹(1.5, 2, 3.5 mm)으로 설계하였다. 그 후 Compaction Rate, Live/Dead Imaging 분석을 통해 근육 세포의 정렬 및 수축에 가장 적합한 너비의 몰드를 선정하였다.
위 과정을 통해 여러 조건의 몰드를 정량적으로 평가하여 최적화된 구조를 제시하였다. 본 연구는 골격근 조직 제작용 앵커형 몰드의 구조적 설계 기준을 정립하고 재생의학 및 생체 조직 플랫폼 개발에 기여할 수 있는 전략적 기반을 제공하고자 한다.
2. 앵커 구조 설계 및 고정력 비교 평가
2.1 선형 및 버섯형 앵커의 구조 비교
본 연구에서는 3차원 골격근 조직 배양을 위한 앵커형 몰드를 제작하고자 SE1700 Clear Base, SE1700 Catalyst, Sylicone Elastomer Base와 Sylicone Elastomer Curing Agent를 9 : 1 : 0.9 : 0.1의 비율로 혼합하여 PDMS를 제조해 활용하였다. 앵커 구조를 포함한 몰드를 12-well Plate 각 Well에 3D 프린팅하여 C2C12 근육 세포의 3차원 배양을 위한 환경을 조성하였다.
앵커 구조는 세포의 방향성 정렬을 유도하고 적절한 기계적 저항성을 가해 근섬유의 분화를 효과적으로 촉진하는 역할을 수행한다. 따라서 조직 고정력 및 기계적 안정성이 앵커 구조 설계에 핵심 요소로 착용하며, 이를 기반으로 두 가지 형태의 앵커를 제작해 비교 분석하였다.
Fig. 1은 선형 앵커와 버섯형 앵커의 구조적 차이 및 G-Code를 시각화 한 것이다.
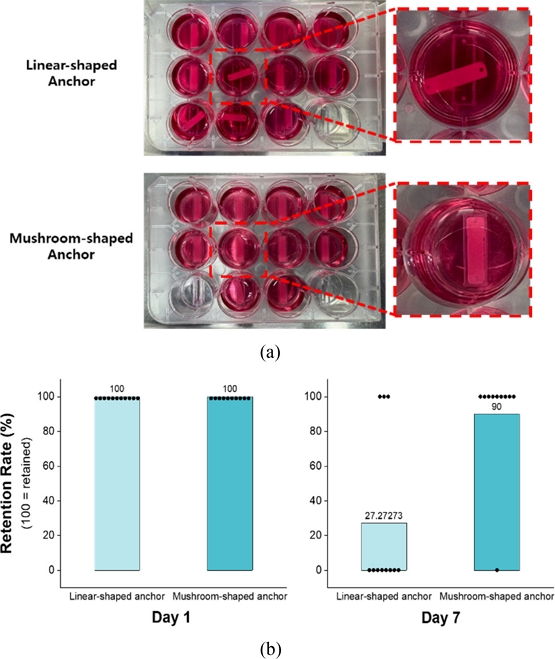
Fig. 1Two types of anchor shapes (a) Linear-shaped anchor, and (b) Mushroom-shaped anchor (F indicates the feed rate of the 3D printer (mm/min), and P denotes the pause time (s) during printing.)

프린팅 조건은 두 앵커 모두 동일하게 하단부에서 1.1초간 정지한 상태에서 PDMS를 압출한 뒤, 20 mm/min 속도로 2.6 mm 길이의 앵커를 프린팅하였다. 그 후 버섯형 앵커의 경우, 상단부 형상을 확장하기 위해 해당 위치에서 추가로 2.5초 동안 정지하도록 설정하였다.
2.2 앵커 형태에 따른 근육 구조체 탈락 여부 비교
두 가지 유형의 앵커 구조를 결정한 뒤 각 앵커 형태에 따른 골격근 조직의 고정 안정성 및 유지 가능성을 비교 분석하기 위해, 각각 선형 앵커와 버섯형 앵커가 포함된 앵커형 직사각형 몰드를 12-well plate에 프린팅하였다.
C2C12 근육 세포는 5 mg/mL 농도의 dECM에 1×107 cells/mL의 농도로 봉입(Encapsulation)하였다. 본 연구에서는 세포가 도포되는 well 표면에 대한 비특이적 부착을 방지하기 위해 2시간 동안 3% PF127 (Pluronic F127) 용액을 처리한 뒤, PBS로 세척하였다. 몰드가 완전히 건조된 상태에서 세포가 봉입된 dECM을 각 well 당 90 μl씩 분주하였다. 이후 약 1시간 동안 37oC Incubator에서 보관하여 dECM의 겔화(Gelation)을 유도하였으며 겔화가 완료된 후 DMEM High Glucose 기반의 10% FBS, 1% Penicillin-streptomycin으로 구성된 Growth Media (GM)를 처리하였다.
구조체의 자발적인 수축(Compaction)을 유도하기 위해 배지는 DMEM High Glucose 기반의 2% Horse Serum, 1% Penicillin-streptomycin으로 구성된 Differentiation Media (DM)로 교체해 총 7일간 배양을 진행하였다. 세포 기반 겔 수축은 하이드로젤 내에서 세포가 섬유 방향으로 뻗어나가면서 겔을 수축시키고, 이때 앵커 구조에 의해 일방향성 장력이 형성되어 세포 정렬(Alignment)을 유도하게 된다.
두 가지 유형의 앵커 구조에 따라 조직 구조체의 고정 안정성을 중심으로 관찰하였다(
Fig. 2(a)). 관찰 결과를 기반으로 12-well Plate 내 각 well의 골격근 조직 유지 여부를 조건 별로 비교 분석하였다(
Fig. 2(b)).
Fig. 2Engineered muscle constructs formed using two different anchor types (a) Tissue stability and retention after 7 days of culture, comparing linear and mushroom-shaped anchors, and (b) Comparison of retention rate at day 1 and day 7 for the two anchor types
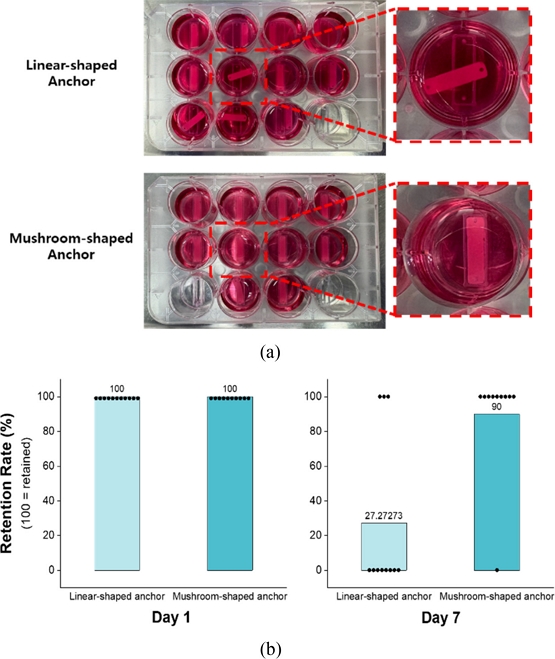
분석 결과, Linear-shaped Anchor의 경우 상단부 구조가 얇고 뾰족한 형상을 띠고 있어 조직 구조체가 수축하거나 배양액 교체 등 외부 물리적 자극에 의해 몰드로부터 쉽게 탈락되는 경향을 보였다. 반면, Mushroom-shaped Anchor는 상단부가 하단부에 비해 확장된 구조로 제작되어 조직 구조체가 앵커에 물리적으로 고정되었다. 결과적으로 Linear-shaped Anchor, Mushroom-shaped Anchor 각각 11개의 구조체 중 3개, 10개의 구조체 중 9개가 유지되며 Mushroom-shaped Anchor가 탈락 없이 안정적으로 유지되는 양상을 보였다.
본 실험을 통해 골격근 조직의 고정 안정성을 확보하기 위한 앵커 구조로 Mushroom-shaped Anchor가 적합함을 확인하였다.
3. 근육 조직 안정성 향상을 위한 프레임 구조 최적화
3.1 직사각형 프레임 내 근육 세포 생존율 분석
앞서 실험을 통해 최적의 앵커 구조를 확립한 이후, 골격근 조직의 장기적 안정성과 방향성 있는 수축 유도를 가능케 하는 몰드의 프레임 구조를 추가적으로 최적화하고자 하였다. 초기 설계로 사용된 직사각형 프레임이 구조체 수축 및 세포 생존에 미치는 영향을 평가하기 위해, 7일간 골격근 조직을 배양하였다.
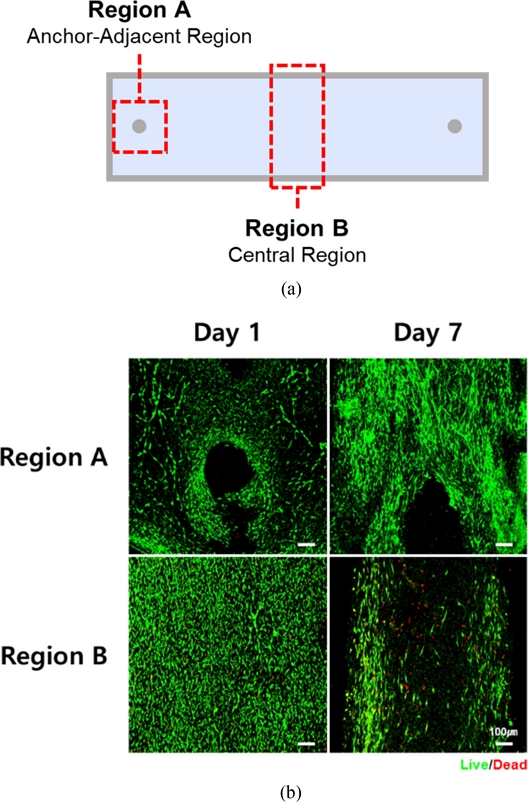
세포의 분화 상태 및 생존율 평가를 위해 조직 구조체의 Anchor-adjacent Region과 Central Region을 중심으로 Day 1, Day 7 시점에서 Live/Dead Staining을 진행하였다(
Fig. 3(a)). Day 1의 경우, 구조체 전반에 걸쳐 세포가 균일하게 배열되어 있고 세포 사멸도 관찰되지 않았다. 반면 Day 7에는 중심부에서의 세포 사멸이 증가하였고 앵커 방향으로의 세포 이동이 뚜렷하게 관찰되었다(
Fig. 3(b)).
Fig. 3(a) Schematic illustration of 3D printed rectangular molds for engineered muscles, and (b) Live/Dead images of engineered muscles in rectangular frame (Live cells are shown in green; dead cells in red. Scale bar = 100 μm)
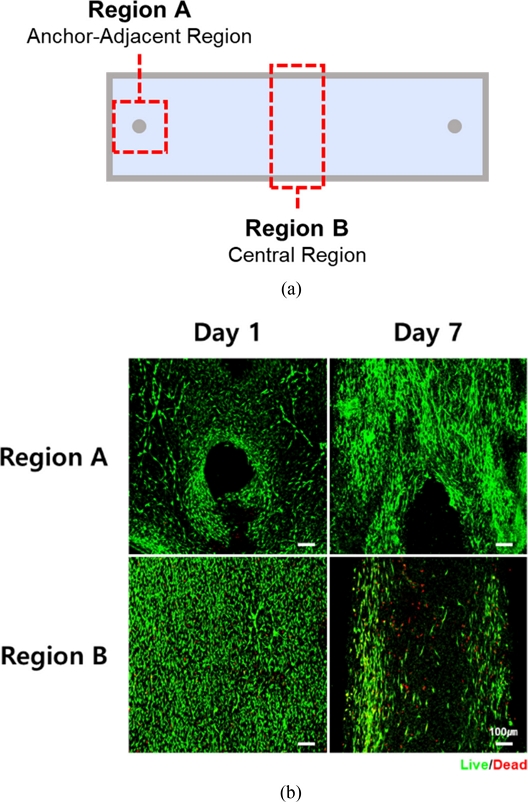
이러한 현상은 앵커로부터 발생하는 장력으로 인해 구조체 수축이 발생함에 따라 응력이 앵커 중심으로 집중되면서 나타난 것으로 보인다. 따라서 세포가 불균일하게 정렬되고 중심부로의 산소 및 영양분 확산 제한에 기인한 것으로 판단된다.
특히 중심부에서 관찰된 세포 사멸은 저산소증(Hypoxia) 및 괴사(Necrosis)에 의한 것일 가능성이 있으나, 정확한 원인 규명을 위해서는 추가적인 분석과 실험이 필요하다.
3.2 프레임 너비 변화에 따른 구조체 수축율 및 세포 생존율 비교
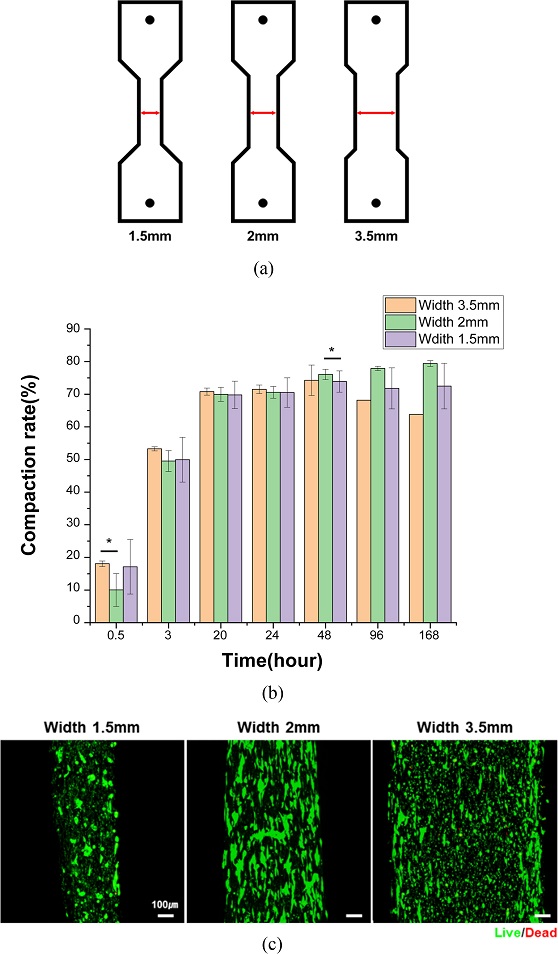
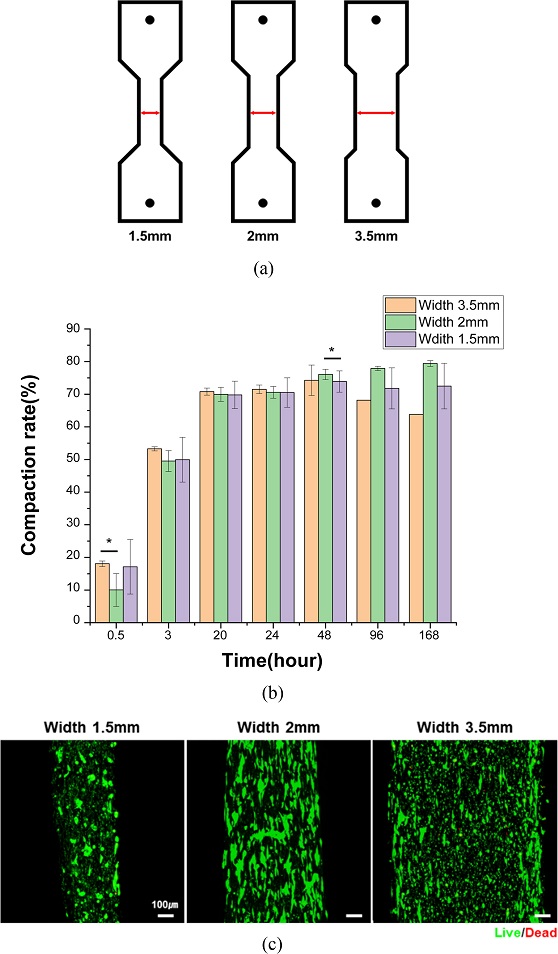
직사각형 몰드에서 관찰된 중심부 세포 정렬의 저해, 생존율 감소, 과도한 조직 수축 현상이 관찰됨에 따라, 이러한 문제를 해결하고자 몰드 중앙부의 폭을 좁힌 덤벨(Dumbbell)형 디자인을 도입하였다. 특히 조직의 안정적 유지와 적절한 수축을 유도하는 최적의 조건을 도출하기 위해 중앙부 너비를 1.5, 2, 3.5 mm로 설정한 세 가지 조건의 몰드를 제작하여 실험을 진행하였다(
Fig. 4(a)).
Fig. 4Differences in engineered muscles according to mold widths (a) Schematic illustration of 3D printed molds for engineered muscles with different widths, (b) Compaction rate of engineered muscles with different widths, and (c) Live/Dead images of engineered muscle with different widths on day 14 (Green indicates live cells, red indicates dead cells. Scale bars = 100 μm)
골격근 구조체의 수축 정도를 정량적으로 분석하기 위해 배양 기간 동안 시간 경과에 따른 각 조건의 중앙부 너비를 광학현미경을 통해 측정하였다. 이후 측정된 값을 바탕으로 아래
식(1)을 이용해 Compaction rate를 계산하였다. 여기서 W
initial은 배양 1일차의 구조체 중앙부 너비이며, W
t는 각 시간대별로 측정한 구조체 중앙부 너비를 의미한다.
골격근 구조체의 Compaction Rate 분석 결과, 2 mm 조건에서 가장 높은 수축율이 나타났으며, 3.5와 1.5 mm 조건은 상대적으로 낮았다(
Fig. 4(b)).
Live/Dead Staining 결과, 세포 생존율 측면에서는 세 조건 간 큰 차이를 보이지 않았지만 형태학적으로 2 mm 그룹에서 세포들이 길게 뻗은 형태를 유지하며 균일하게 분포하였다.
특히 1.5 mm 조건에서는 중앙부의 수축으로 인해 기계적 응력이 집중되었고, 조직이 이를 견디지 못해 구조체 파열이 빈번히 발생하였다. 이로 인해 세포의 정렬이 불균일하게 이루어졌으며, 일부 영역에서는 둥글고 응집된 형태의 세포가 관찰되었다. 3.5 mm 조건에서도 직사각형 몰드에서 배양한 구조체에서 나타난 문제와 유사하게 세포 정렬의 불균일성이 확인되었으며, 중앙부에 둥글고 응집된 세포가 집중되어 분포하는 경향을 보였다.
위 결과에 기반하여 2 mm 너비의 덤벨형 몰드가 조직 수축, 세포의 원활한 정렬 및 구조체 유지 측면에서 가장 안정적인 조건으로 판단하였다.
4. 결론
본 연구에서는 구조적 안정성과 기능적 성숙을 동시에 달성할 수 있는 최적의 앵커형 몰드를 개발하기 위해 앵커 형상과 프레임 구조를 중심으로 설계를 최적화하였다. Mushroom-shaped Anchor는 Linear-shaped Anchor에 비해 조직의 탈락율이 현저히 낮아 구조체의 고정 안정성 측면에서 우수한 성능을 보였다. 프레임 구조의 경우, 중앙부 폭이 2 mm인 덤벨형 몰드에서 가장 높은 Compaction Rate와 형태학적으로 안정된 세포 구조 및 배열이 관찰되었다.
비록 Myosin Heavy Chain (MHC) 염색을 통한 Myotube 형성 여부는 본 연구에서 직접적으로 제시되지는 않았으나, 세포 정렬 및 구조체 유지 측면에서 본 몰드 디자인은 골격근 조직공학에 적합한 조건을 제공함을 확인하였다. 따라서
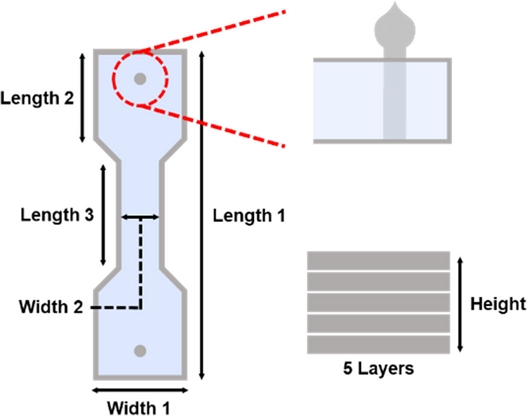
Table 1과
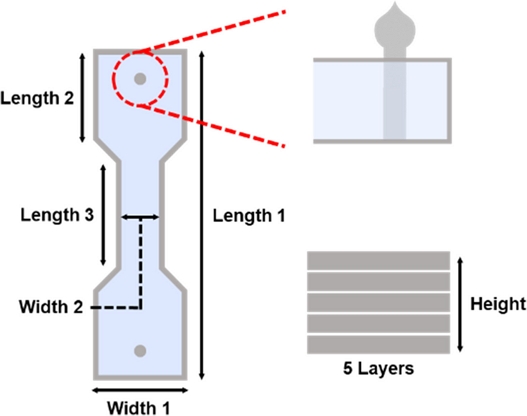
Fig. 5와 같이 Mushroom-shaped Anchor와 좁은 중앙부를 갖는 덤벨형 몰드를 결합한 본 설계는 향후 조직공학 기반 인공 근육 제작 플랫폼으로의 활용 가능성을 제시한다.
Table 1 Dimensional information of optimal 3D printed mold for engineered muscle fabrication
Table 1
|
Length 1 [mm] |
17.4 |
|
Length 2 [mm] |
4.7 |
|
Length 3 [mm] |
6 |
|
Width 1 [mm] |
5 |
|
Width 2 [mm] |
2 |
|
Height [mm] |
1.5 |
Fig. 5 Schematic illustration of optimal 3D printed mold for engineered muscle fabrication
ACKNOWLEDGMENTS
본 연구는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원(No. RS-2024-00423107)을 받아 수행되었으며, 국가과학기술연구회가 시행한 한국재료연구원의 기본사업(PNKA630)의 일환으로 진행되었음.
REFERENCES
- 1.
Frontera, W. R., Ochala, J., (2015), Skeletal muscle: A brief review of structure and function, Calcified Tissue International, 96(3), 183-195.
10.1007/s00223-014-9915-y
- 2.
Hulett, N. A., Scalzo, R. L., Reusch, J. E., (2022), Glucose uptake by skeletal muscle within the contexts of type 2 diabetes and exercise: An integrated approach, Nutrients, 14(3), 647.
10.3390/nu14030647
- 3.
Wang, J., Khodabukus, A., Rao, L., Vandusen, K., Abutaleb, N., Bursac, N., (2019), Engineered skeletal muscles for disease modeling and drug discovery, Biomaterials, 221, 119416.
10.1016/j.biomaterials.2019.119416
- 4.
Capel, A. J., Rimington, R. P., Fleming, J. W., Player, D. J., Baker, L. A., Turner, M. C., Jones, J. M., Martin, N. R., Ferguson, R. A., Mudera, V. C., (2019), Scalable 3D printed molds for human tissue engineered skeletal muscle, Frontiers in Bioengineering and Biotechnology, 7, 20.
10.3389/fbioe.2019.00020
- 5.
Iuliano, A., van der Wal, E., Ruijmbeek, C. W., in ‘t Groen, S. L., Pijnappel, W. P., de Greef, J. C., Saggiomo, V., (2020), Coupling 3D printing and novel replica molding for in house fabrication of skeletal muscle tissue engineering devices, Advanced Materials Technologies, 5(9), 2000344.
10.1002/admt.202000344
- 6.
Akter, M. Z., Tufail, F., Ahmad, A., Oh, Y. W., Kim, J. M., Kim, S., Hasan, M. M., Li, L., Lee, D.-W., Kim, Y. S., (2025), Harnessing native blueprints for designing bioinks to bioprint functional cardiac tissue, iScience, 28(3).
10.1016/j.isci.2025.111882
- 7.
Choi, Y. J., Kim, T. G., Jeong, J., Yi, H. G., Park, J. W., Hwang, W., Cho, D. W., (2016), 3D cell printing of functional skeletal muscle constructs using skeletal muscle‐derived bioink, Advanced healthcare materials, 5(20), 2636-2645.
10.1002/adhm.201600483
- 8.
Choi, Y.-J., Jun, Y.-J., Kim, D. Y., Yi, H.-G., Chae, S.-H., Kang, J., Lee, J., Gao, G., Kong, J.-S., Jang, J., (2019), A 3D cell printed muscle construct with tissue-derived bioink for the treatment of volumetric muscle loss, Biomaterials, 206, 160-169.
10.1016/j.biomaterials.2019.03.036
- 9.
Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F., (2017), Extracellular matrix hydrogels from decellularized tissues: Structure and function, Acta Biomaterialia, 49, 1-15.
10.1016/j.actbio.2016.11.068
- 10.
Denes, L. T., Riley, L. A., Mijares, J. R., Arboleda, J. D., McKee, K., Esser, K. A., Wang, E. T., (2019), Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation, Skeletal Muscle, 9(1), 17.
10.1186/s13395-019-0203-4
Biography
- Hyunji Yang
Intern Researcher, Advanced Bio and Healthcare Materials Research Division, Korea Institute of Materials Science (KIMS).
- Minju Choi
Master’s Degree Researcher, Advanced Bio and Healthcare Materials Research Division, Korea Institute of Materials Science (KIMS)
- Yeong-Jin Choi
Ph. D. Senior Researcher, Advanced Bio and Healthcare Materials Research Division, Korea Institute of Materials Science (KIMS), Associate Professor, Advanced Materials Engineering, Korea National University of Science and Technology (UST).