ABSTRACT
Improving the interfacial stability between cathode active material (CAM) and solid electrolyte (SE) is essential for enhancing the performance and durability of all-solid-state batteries (ASSBs). One promising method to achieve this is through surface coating with a chemically stable ion conductor, which helps suppress interfacial side reactions and improve long-term cycling stability. In this study, we deposited a uniform LiNbO3 (LNO) protective layer on NCA using particle atomic layer deposition (Particle ALD). This technique utilizes a self-limiting growth mechanism to ensure precise thickness control. We characterized the structural and chemical properties of the coated CAM with X-ray photoelectron spectroscopy (XPS), X-ray diffraction (XRD), and scanning electron microscopy-energy dispersive spectroscopy (SEM-EDS), confirming the successful formation of a uniform LNO layer. Electrochemical evaluations revealed that LNO@NCA exhibited significantly improved capacity retention, maintaining 68.1% after 50 cycles at a 1C rate, compared to just 56.5% for the uncoated sample. This enhancement is attributed to the LNO layer's effectiveness in mitigating electrochemical side reactions. These findings demonstrate that Particle ALD-derived LNO coatings are an effective strategy for stabilizing CAM|SE interfaces and extending the cycle life of high-energy ASSBs.
-
KEYWORDS: Interfacial stability, Atomic layer deposition, Protective coating, Ni-rich cathode, All-solid-state batteries
-
KEYWORDS: 계면 안정성, 원자층 증착, 보호 코팅, 고함량 니켈 양극, 전고체 배터리
1. 서론
현대의 전기차와 휴대폰을 비롯한 다양한 응용 분야에서 고성능 에너지 저장 장치에 대한 수요가 증가하고 있다. 특히, 높은 비에너지 밀도와 안정된 사이클링 성능을 갖춘 리튬 이온 배터리는 에너지 저장 시장에 혁신을 가져왔으며, 휴대용 전자기기와 전기차의 광범위한 보급을 가능하게 했다[
1]. 기존 리튬 이온 배터리에는 액체 전해질이 사용되며, 이 액체 전해질은 주로 유기 용매 기반으로 구성되어 인화성이 높다. 배터리 내부 온도가 급격히 상승하면, 전해질이 분해되며 연소되는 열폭주 현상이 발생할 수 있으며, 이는 화재나 폭발로 이어질 위험이 있다[
2]. 이러한 문제를 해결하기 위한 대안으로 전고체 배터리가 주목받고 있다. 전고체 배터리는 모든 구성 요소가 고체로 이루어져 있으며, 고체 전해질의 비가연성으로 인해 열폭주 현상을 완화할 수 있다. 또한 덴드라이트 형성을 저감하여 금속 음극 적용을 가능하게 함으로써 에너지 밀도를 향상시킨다. 이와 함께, 셀 포장 효율을 개선하는 새로운 구조를 도입할 수 있으며, 사이클 수명 향상과 고전압 양극 사용을 지원할 잠재력을 가진다[
3]. 고체 전해질 내에서 이온 전도는 주로 결함 부위에서 발생하며, 특히 공공이나 이웃한 이온 간의 간극을 통한 호핑(Hopping) 메커니즘에 의해 이루어진다[
4]. 이러한 리튬 이온 고체 전해질의 개발은 최근 몇 년간 빠르게 진행되었으며, 일부 시스템에서는 액체 전해질의 전도성과 유사한 수준에 도달했다[
3].
전고체 배터리의 양극 활물질은 층상 구조, 스피넬 구조, 올리빈 구조로 분류할 수 있으며, 올리빈 구조를 가지는 대표적인 물질로는 리튬 인산 철(Li
xFePO
4, LFP)이 있다. LFP는 저비용과 무독성이라는 장점이 있지만, 낮은 이온 전도도로 인해 에너지 밀도가 낮다는 단점이 있다. 리튬 산화물 계열에는 LiₓCoO
2(LCO)와 LiₓMn
2O
4 (LMO)가 있으며, LCO는 층상 구조, LMO는 스피넬 구조를 가진다. 이 두 물질은 LFP에 비해 개선된 이온 전도도를 제공하지만, LCO는 고비용의 코발트(Co)를 사용해야 하며, LMO는 충 방전 과정 중 얀-텔러 뒤틀림 현상, 전해액 내에서의 망간 용출로 인해 용량이 심각하게 감소되는 단점이 있다[
5,
6]. 이러한 문제를 해결하기 위한 대안으로 고니켈(Ni-rich) 층상 리튬 금속 산화물이 주목받고 있으며, 특히 고에너지 밀도가 요구되는 전고체 배터리(ASSB) 분야에서 최첨단 양극 소재로 활용되고 있다. 고니켈 층상 구조의 대표적인 물질로는 LiNi
1-x-γCoₓMn
γO
2(NCM 또는 NMC)와 LiNi
1-x-zCoₓAl
ZO
2(NCA)가 있으며, 니켈 함량을 높여 에너지 밀도를 향상시키고 코발트 함량을 줄여 비용 절감 효과를 기대할 수 있다. 특히, 망간(Mn)을 사용하는 NCM에 비해 상대적으로 저렴한 알루미늄(Al)을 사용하는 NCA는 전이 금속-산소(TM-O) 결합 구조에서 Mn-O 결합보다 강한 Al-O 결합을 형성해 우수한 구조적 안정성을 제공한다[
7].
고체 전해질은 산화물계, 황화물계, 폴리머계로 구분되며, 각각의 장점과 한계가 있다. 폴리머계 고체 전해질은 유연성과 가공성이 뛰어나지만, 낮은 이온 전도도가 단점으로 지적된다[
8]. 산화물계 고체 전해질은 화학적 안정성이 높으며, 대표적인 예로 LiₓPOᵧNₓ(LiPON), Li
7La
3Zr
2O
12(LLZO, Garnet 구조), LiLaTiO
3(LLTO, Perovskite 구조) 등이 있다. 이 중 LiPON은 대용량 배터리로 제조하기 어렵기 때문에 대규모 에너지 저장 분야에서의 활용이 제한된다. 반면, LLZO와 LLTO 같은 산화물계 고체 전해질과 비교할 때, 황화물계 고체 전해질은 액체 전해질에 필적할 만큼 높은 이온 전도도를 가지는 것이 특징이다[
9]. 황화물계 고체 전해질의 종류에는 Li-P-S (LPS) 황화물, Glass-ceramics, Argyrodite형 Li
6PS
5X, thio-LISICONs (리튬 초이온 전도체) 및 유사 화합물, 그리고 Li
10GeP
2S
12 (LGPS) 및 유사 화합물이 있다. 이 중, Argyrodite형 Li
6PS
5Cl은 약 10
-3 S∙cm
-1 이상의 높은 전도성을 보유하고 있다[
10].
그러나 황화물계 고체 전해질은 여전히 해결해야 할 여러 주요 과제를 안고 있다. 대표적으로 좁은 전기화학적 안정성 창, 전해질과 전극 간 불안정한 계면이 있다[
11]. 이를 해결하기 위해 양극 활물질과 고체 전해질 계면에 안정된 물질로 구성된 버퍼 층을 코팅하는 방법이 주목받고 있다. 버퍼 층은 전해질 분해를 억제해 이차 상 생성을 방지하여 안정된 계면을 형성할 뿐만 아니라, 계면의 전위 차이를 완화함으로써 공간 전하 층 형성을 억제할 수 있다. 이는 배터리의 사이클 안정성과 성능을 크게 향상시킬 수 있다[
12].
버퍼 층으로 사용되는 소재는 크게 삼원 금속 산화물과 폴리아니온 계열로 구분할 수 있다. 삼원 금속 산화물은 산소와 두 가지 이상의 금속 이온으로 구성된 산화물로, 대표적인 예로 Li
2ZrO
3 (LZO), LiNbO
3 (LNO), LiTaO
3 (LTO) 등이 있다. 반면, 폴리아니온 산화물은 폴리아니온 구조(-PO
43-, -SO
42-, -SiO
44- 등)을 포함한 화합물로 이루어져 있으며, 대표적인 소재로 LiH
2PO
4, LiTi
2(PO
4)
3, LiBa(B
3O₅)
3, LiPO
3, LiLa(PO
3)
4, LiCs(PO
3)
2 등이 있다. 이러한 물질을 이용한 코팅은 산화물계 양극과 황화물계 고체 전해질의 계면에서 안정성을 제공하여 부반응을 억제하고 전기화학적 성능을 향상시킨다. 그러나 폴리아니온 계열 중 인산염 기반 코팅은 산화물 코팅에 비해 산화물 양극과의 반응성이 상대적으로 높으며, Li
3PO
4 상을 형성하는 경향이 있다. 특히, PO
3- 그룹을 포함한 메타인산염은 PO
43- 그룹을 형성하기 위해 산화물 양극에서 산소를 얻으려는 성질을 가진다. 심지어 이미 PO
43- 그룹을 포함한 LiTi
2(PO
4)
3와 같은 오르토인산염조차도 전이 금속을 방출하고 양극으로부터 리튬을 흡수해 Li
3PO
4 상을 형성한다. 이러한 Li
3PO
4은 화학적으로 안정하여 양극과 전해질 간의 부반응을 억제할 수 있다. 하지만 Li
3PO
4 상은 충방전시 자연스럽게 발생하게 되며 상의 두께를 임의로 조절하기 쉽지 않다. 특히, 상이 너무 두꺼워지면 오히려 리튬 이온의 확산을 저해하여 배터리 성능을 저하시킨다. 반면, 일부 삼원 금속 산화물 코팅은 완전히 리튬화된 상태 또는 절반 리튬화된 상태 모두에서 양극과 반응할 동력이 없다. 폴리아니온 계열 버퍼층과 달리 추가적인 상 형성이 없다. 이는 우리가 원하는 만큼 버퍼층을 조절할 수 있음을 나타낸다. 특히 LZO와 LTO에 비해 완전히 리튬화된 양극과 상대적으로 더 낮은 화학적 반응성을 가지는 LNO는 황화물계 고체 전해질을 사용하는 양극 활물질의 코팅층으로 효과적으로 사용되고 있다[
13].
코팅층은 최적의 나노스케일 두께, 구조적/형태적 균일성을 가져야 한다. 이러한 특징은 계면에서 빠른 반응 동역학을 보장하고, 배터리의 사이클 수명과 속도 성능측면에서 최상의 성능을 달성할 수 있게 해주기 때문이다. 이러한 특징을 확보하기 위해서는 정밀도가 높은 증착 장비가 필요하다. 이를 위해 PLD (Pulsed Laser Deposition), ALD (Atomic Layer Deposition), Sputtering, CSD (Chemical Solution Deposition) 방식이 널리 사용된다. PLD 방식은 레이저를 타겟에 조사하여 타겟 표면의 입자가 방출되고, 이로 인해 형성된 플라즈마 플룸이 기판에 증착되는 방식이다. PLD는 다양한 물질을 증착할 수 있어 생체 적합성 박막부터 리튬 이온 배터리의 양극 및 박막 고체산화물 연료전지(SOFC) 전해질에 이르기까지 폭넓게 활용된다. 스퍼터링 방식 또한 많이 사용되는 증착 방식으로, 고에너지의 원자 크기 입자가 타겟 표면을 충돌하여 운동량을 전달함으로써 타겟 원자가 기화되어 기판에 증착되는 원리이다[
14]. 반면, CSD 방식은 비진공 환경에서 용액을 사용해 증착을 진행하며, Sol-gel 공정과 결합하여 사용되는 간단한 박막 제조 방식으로 사용된다[
15]. 하지만, PLD, 스퍼터링, CSD와 같은 물리적 기상 증착(PVD) 방식의 공정은 선형 투과(Line-of-sight) 매커니즘의 코팅 방식의 한계 때문에 양극 활물질 입자 표면의 전체를 균일하게 코팅하기에 한계가 있다. 따라서, 균일한 박막을 정밀하게 증착하기 위해서는 이러한 증착 방식들보다 높은 정밀도를 가진 ALD(원자층 증착) 방식이 주목받고 있다. ALD는 화학적 기상 증착(CVD)의 일종으로, 전구체 가스를 일정 시간 간격으로 펄스 형태로 주입하여 증착 과정을 순차적으로 제어하며, 주입 횟수(사이클)를 조절함으로써 코팅층의 두께와 화학적 물성을 정밀하게 조절할 수 있다. 또한, 펌핑(Pumping)과 퍼징(Purging) 과정을 통해 전구체 간의 기체상 반응을 방지하여 균일하고 안정된 코팅층을 형성할 수 있는 자기 제한적 순차 반응(Self-limiting Sequence) 특성을 가지고 있다[
16]. 특히 P-ALD(Particle Atomic Layer Deposition, 입자 원자층 증착) 방식은 기판이 아닌 입자의 표면에 얇고 균일한 코팅층을 형성할 수 있어, 전고체 배터리 양극 활물질 표면 보호 코팅에 효과적으로 적용될 수 있다[
12].
따라서, 본 연구에서는 P-ALD 방식을 활용하여 NCA 양극 활물질에 LNO 버퍼 층을 증착하고자 한다. LNO 버퍼 층은 정밀한 화학 조성과 얇은 두께, 균일한 박막을 형성할 수 있으며, 이를 통해 계면에서 이차 상 생성을 방지할 뿐만 아니라, 전위 차이를 완화하여 공간 전하 층 형성을 억제할 수 있다. 이러한 특성은 황화물계 고체 전해질의 낮은 계면 안정성 문제를 해결할 수 있으며, 높은 이온 전도도를 기대할 수 있다는 장점이 있다. 또한, ALD 방식은 전고체 배터리뿐만 아니라 연료전지, 반도체 등 다양한 분야로 확장하여 활용할 수 있는 잠재력을 가진다[
17].
2. 실험
2.1 LNO 박막 제작 및 LNO coated NCA 양극 활물질 준비
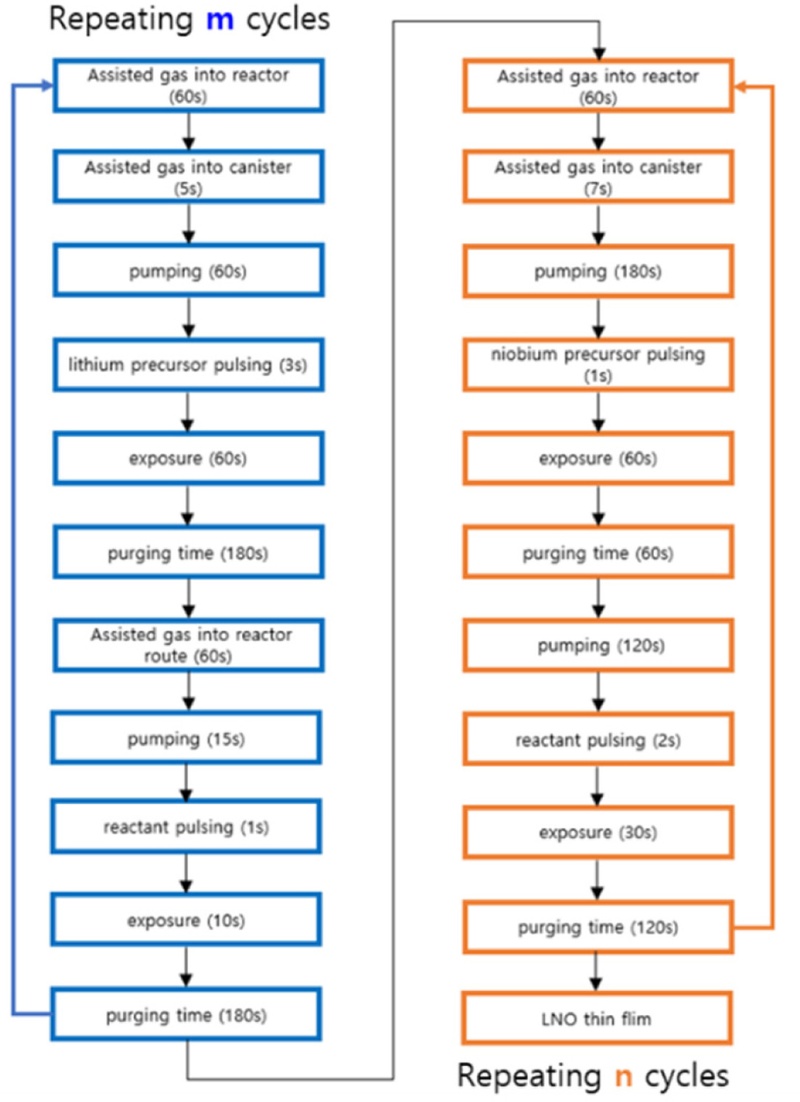
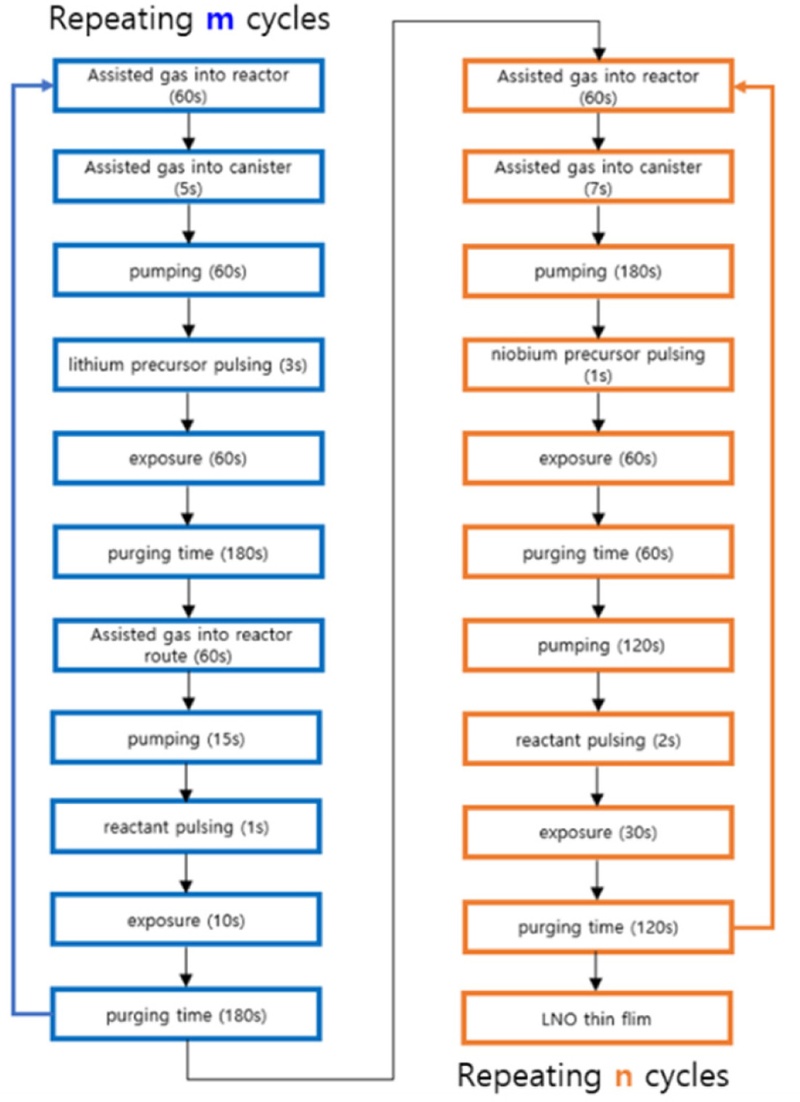
본 연구에서, 리튬 니오븀 산화물 박막 버퍼 층의 제조를 위하여 P-ALD 방법이 사용되었다. 입자 원자층 증착 방식을 사용하여 리튬 니오븀 산화물 박막을 증착하기 위하여 Lithium Tert-butoxide 97% (Sigma-Aldrich)가 리튬의 전구체로 사용되었고, Niobium(V) Ethoxide 99.9% (ThernoFisher SCIENTIFIC)가 니오븀의 전구체로 사용되었다. 이 전구체들은 반응물인 탈이온수와 반응하여 최종적으로 Li2O와 Nb2O5를 형성하게 된다. 리튬 전구체의 히팅 온도는 200oC, 니오븀 전구체의 히팅 온도는 160oC로 설정하였다.
P-ALD의 자기 제한적 순차 반응(Self-limiting Sequence)을 통하여 정밀한 두께 및 균일한 박막 성장을 목표로 하였다. 리튬 산화물(Li2O)과 니오븀 산화물(Nb2O5)의 증착 비율(m : n)을 1 : 4로 설정하여 LNO의 화학적 조성을 LiNbO3와 유사하게 제작하였다.
리튬 니오븀 산화물을 합성하기 위해 슈퍼사이클(Super-cycle) 증착 방식이 사용되었다.
Fig. 1에 보여지듯이, 먼저 리튬 산화물(Li
2O) 층 형성을 위해 반응기(Reactor)와 캐니스터(Canister) 내의 잔여물 제거 및 청소를 질소(N
2) 가스를 이용하여 각각 60초, 5초동안 흘려보낸다. 이후, 질소(N
2) 가스의 공급을 중단하고 캐니스터 내의 리튬 전구체가 반응기로 확산하기 위하여 60초 동안 Pumping하는 과정을 수행한다. 이후, 리튬 전구체를 3초간 Pulsing하며 60초 동안 노출(Exposure)하는 과정을 거치고 질소 가스를 챔버 내에 주입하여 잔여 리튬 전구체 및 부산물을 제거한다. 이후, 탈이온수를 반응물(Reactant)로 사용하여 반응기로 확산되는 경로에 질소 가스를 주입하여 반응물의 확산을 촉진한다. 반응물은 확산에 의하여 반응기로 1초 동안 Pulsing되며 10초 동안 노출하는 과정을 거친다. 이후, 질소 가스를 챔버 내에 주입하여 잔여 수증기 및 부산물을 제거하는 과정을 거친다. 니오븀 산화물(Nb
2O
5) 층 형성도 유사한 과정으로 진행된다. 질소 가스가 캐니스터에 7초 동안 공급되고 180초 동안 Pumping 과정을 거치며 니오븀 전구체가 1초 동안 Plusing된다. 이후, 60초 동안 노출되며 60초 동안의 Purging 과정을 거치며 120초 동안 Pumping된다. 이후, 2초 동안 반응물인 탈이온수가 Plusing되며 30초 동안의 노출 시간을 거치며 120초 동안 Purging된다. 해당 ALD공정을 이용하여 약 100 um의 LNO박막을 알루미나 기판에 증착한 후, Sputter를 이용하여 Pt 전극을 증착하여 제작된 박막의 이온전도도를 측정하였다. 또한, 슈퍼사이클의 횟수를 7사이클로 조정하여 목표 LNO 코팅층 두께인 5 nm를 증착할 수 있었다. 이때, 사용된 NCA 분말의 양은 3 g이다.
Fig. 1Schematic of LNO deposition process by atomic layer deposition
2.2 LNO 박막이 코팅된 NCA Powder 특성 분석
P-ALD로 NCA 양극 활물질에 증착된 LNO 박막의 원소 분석(정성 및 정량 분석)을 위해 X-선 광전자 분광법(XPS, X-Ray Photoelectron Spectroscopy)을 사용하였다. 이 기법은 시료 표면에서 방출된 전자의 강도와 측정된 운동 에너지로부터 계산된 결합 에너지(Binding Energy)를 바탕으로 XPS 스펙트럼을 생성한다[
18]. 이를 통해 박막의 원소 조성을 분석하였다. 또한, X-선 회절(XRD, X-Ray Diffraction) 분석을 통해 회절 피크의 패턴, 강도, 위치(Bragg 각 θ 또는 평면 간격 d
hkl)를 이용하여 박막의 결정 구조를 확인하였다[
19]. LNO 박막이 코팅된 NCA 입자는 주사전자현미경(SEM, Scanning Electron Microscope)을 사용하여 박막의 표면을 상부와 측면에서 분석하였다. 마지막으로, 에너지 분산형 분광기(EDS, Energy Dispersive Spectroscopy)를 통해 박막의 성장 특성과 성분 분포를 조사하였다. 각 분석 방법을 통해 LNO 박막의 조성, 구조, 표면의 특성을 종합적으로 평가할 수 있었다.
전기화학 분석을 위해 토크 셀 제작을 하였다. 토크 셀 제작은 아르곤(Ar) 분위기의 Glove box 내에서 수행되었으며, 음극으로는 리튬-인듐(Li-In) 금속 호일을 사용하였고 고체 전해질로는 Li6 PS5Cl (LPSCI)를 사용하였다. 토크 셀 제작 과정은 다음과 같다. LNO 박막이 코팅된 NCA 양극재, 전해질(대립 : 소립 = 3 : 1), 도전재를 60 : 35 : 5 비율로 혼합하였다. 이후, 양극재, 도전재, 전해질을 15분 동안 강하게 혼합하였다. 하단 셀에 테플론(Teflon) 실린더를 체결한 후 스테인리스강(SUS) 집전체를 넣고, 그 위에 SUS, 리튬, 인듐 금속 호일 순으로 쌓았다. 그런 다음 전해질 150 mg(대립)을 추가로 넣고, 프레스 압력 게이지가 올라가기 직전까지 눌러준 후, 혼합된 양극 합재 15 mg을 넣고 다시 SUS 집전체를 끼워 5 ton의 힘으로 2분 동안 압력을 가하였다. 이후, 토크 렌치를 사용해 6 N∙m의 토크를 두 번 가하여 셀을 조립하였다. 마지막으로, 제작된 토크 셀을 밀폐된 유리 용기 안에 넣어 보관하였다.
제작된 토크 셀의 충방전 사이클 성능은 45oC의 온도에서 배터리 테스트 시스템을 통해 평가하였다. 충방전 시 C-rate는 1 C (1.8 mAh/g)로 설정하였으며, 50회의 사이클 테스트를 진행하였다.
3. 결과
3.1 LNO 코팅층의 형태 및 결정성 분석
본 논문에서는 LNO로 코팅된 NCA를 LNO-NCA로, 코팅되지 않은 NCA를 Bare-NCA로 명명하기로 한다.
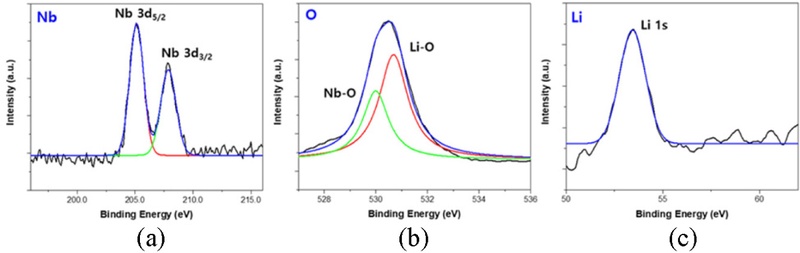
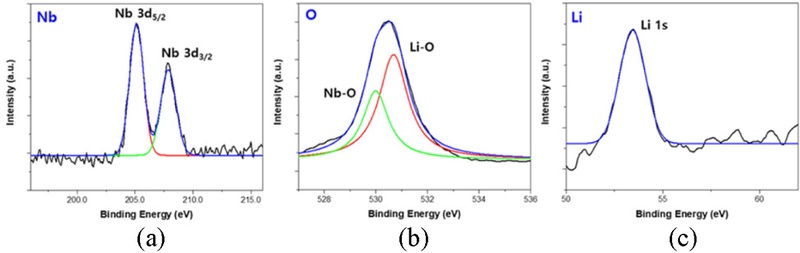
Fig. 1에서 제시된 ALD 과정을 통해 증착된 NCA 양극 활물질의 표면에 LNO 박막이 성공적으로 형성되었는지 확인하기 위해 X-Ray Photoelectron Spectroscopy (XPS) 분석을 수행하였다.
Fig. 2는 LNO-NCA의 LNO 박막 XPS 데이터이며, 이를 통해 Li, O, Nb원소의 결합을 평가하였다.
Fig. 2(a)에서 205 eV와 208 eV에서 피크가 나타났으며, 이는 각각 Nb 3d
5/
2 및 Nb 3d
3/
2에 해당하는 것으로 확인되었다. 이러한 피크는 Nb
2O
5에서 기인한 것으로 해석된다. 또한,
Fig. 2(b)에서는 530.7 eV와 530 eV에서 피크가 관찰되었으며, 각각 Li-O(Li
2O) 및 Nb-O(Nb
2O
5) 결합에서 유래한 것으로 분석되었다. 마지막으로,
Fig. 2(c)에서는 53 eV에서 피크가 확인되었으며, 이는 Li 1s의 결합에너지에 해당함을 보여준다. 이러한 XPS 분석 결과를 종합적으로 검토한 결과, NCA 표면에 LNO 박막이 성공적으로 증착되었음을 확인할 수 있었다.
Fig. 2XPS data of (a) Nb 3d, (b) O 1s, and (c) Li 1s of particle ALD LNO on the NCA particles
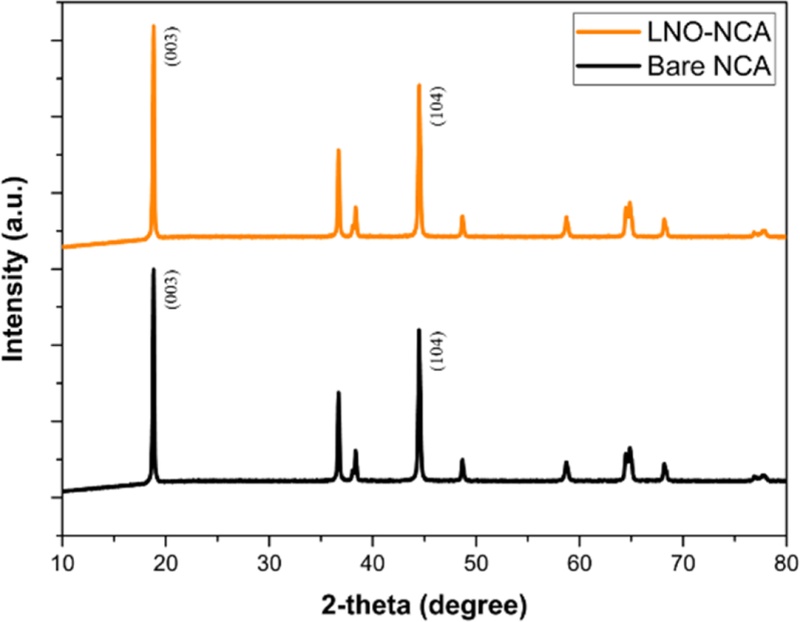
X-ray Diffraction (XRD) 분석을 통해 LNO-NCA와 Bare-NCA의 결정 구조를 비교하였다.
Fig. 3의 XRD 데이터에서 LNO-NCA와 Bare-NCA의 (003) 및 (104) 회절 피크의 위치는 각각 18.82°, 18.82° / 44.48°, 44.50°로 나타났고 강도는 유사하게 나타났다. 일반적으로 고온 증착이나 증착 후 열처리 과정에서는 격자 내 응력이 유발되어, 기판과 박막 사이의 격자 불일치(Mismatch)로 인해 회절 피크의 위치가 이동하는 현상(Peak Shift)이 발생한다[
19]. 그러나
Fig. 3에서 (003) 및 (104) 피크의 위치 차이가 각각 0.00°, 0.02°로, LNO 증착 온도 조건에서 양극 활물질(NCA)의 격자 구조에 영향을 줄 만한 열적 효과가 발생하지 않았음을 의미한다. 피크의 상대 강도 비(I(003)/I(104))를 통해 양이온 혼합의 정도와 결정성을 정량적으로 평가했다[
20].
Fig. 3XRD data of Bare-NCA, LNO-NCA
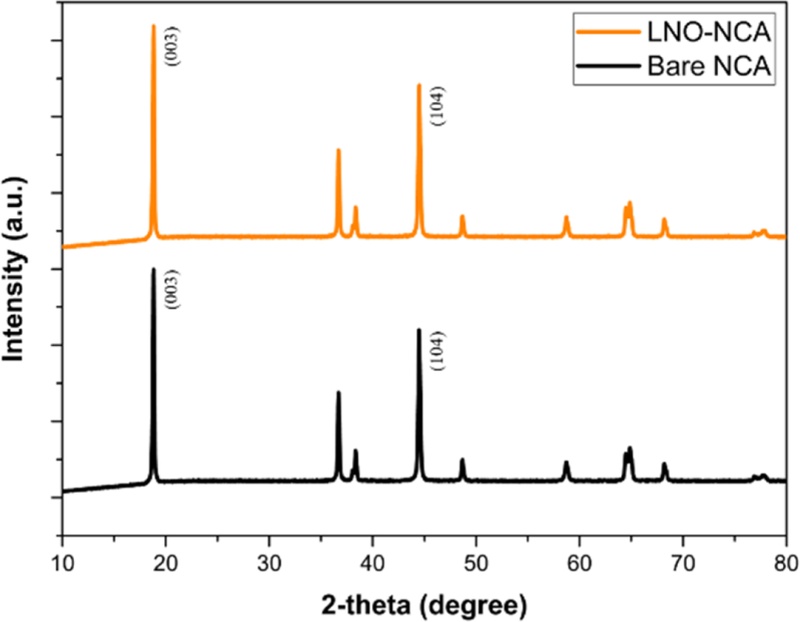
LNO-NCA와 Bare-NCA의 I(003)/I(104) 비율은 각각 1.3611과 1.3614로 거의 동일하게 나타났으며, 이는 두 시편 모두 층상 구조의 안정성이 유지되고 있으며, LNO 증착이 양이온 혼합(Cation Mixing)이나 구조적 열화를 유발하지 않았음을 시사한다. 하지만
Fig. 3의 결과에서 증착된 LNO의 비정질(Amorphous) 구조와 매우 얇은 두께로 뚜렷한 회절 피크가 나타나지 않았다[
21]. 따라서, LNO 박막의 원소 조성을 분석하고 균일하게 코팅되었는지를 확인하기 위해 추가적으로 EDS 분석을 수행하였다.
Fig. 4는 LNO-NCA 분말의 SEM-EDS 이미지이다. SEM-EDS Mapping을 통해 O, Al, Co, Ni, Nb 원소들이 표면에 균일하게 분포하고 있음을 확인할 수 있다. 이는 P-ALD 공정을 통해 증착된 LNO 층이 자기 제한적 순차 반응(Self-limiting Sequence)의 특성에 따라 균일하고 안정적인 코팅층을 형성했음을 의미한다.
Fig. 4(a) SEM image of LNO-NCA powder, (b) EDS mapping image for O element, (c) AI element, (d) Co element, (e) Ni element, and (f) Nb element

3.2 LNO 코팅된 NCA의 셀 성능 평가
3.2.1 LNO 코팅을 통한 NCA 양극의 방전 용량 유지율 향상 및 계면 안정성 분석
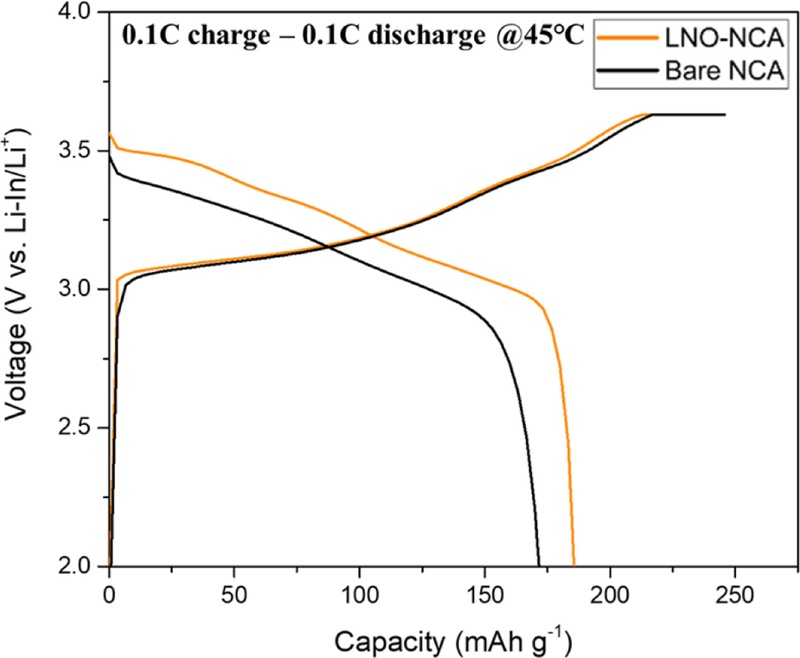
제작된 토크 셀을 이용하여 0.1 C의 C-rate로 45
oC에서 1회 사이클링을 수행한 후, 충·방전 성능 곡선을 측정하였다.
Fig. 5에서 충전 용량은 Bare-NCA의 경우 약 233.43 mAhg
-1, LNO-NCA의 경우 약 245.01 mAhg
-1로 나타났으며, 방전 용량은 LNO-NCA에서 약 210.38 mAhg
-1로 측정되어 Bare-NCA(184.67 mAhg
-1)보다 25.71 mAhg
-1 높은 값을 보였다.
Fig. 5Charge-discharge curves of Bare NCA and LNO-NCA at 0.1C
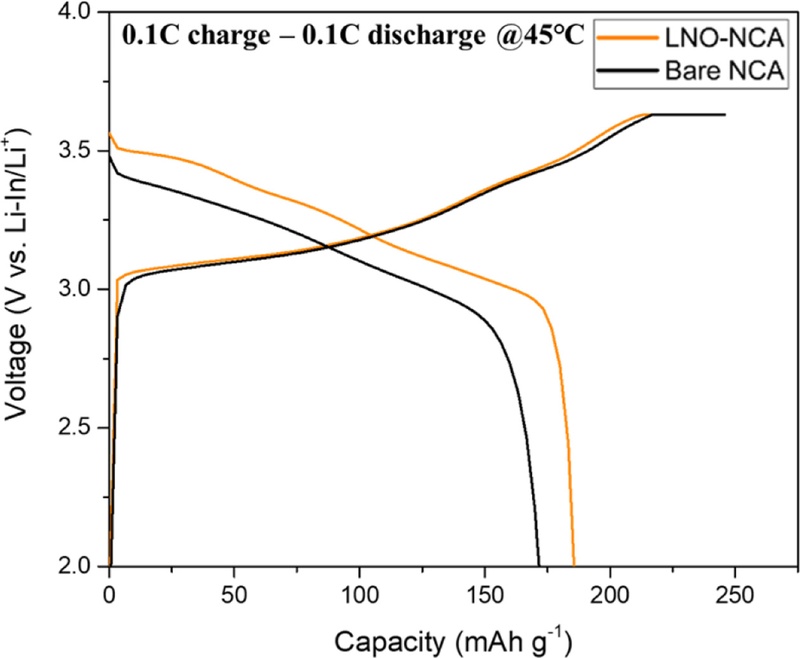
이는 양극 활물질과 고체 전해질 사이의 계면에서 부반응이 발생하면서 CEI (Cathode Electrolyte Interphase) 층이 형성되는데, 이 층이 고저항성 층으로 작용하여 초기 쿨롱 효율 감소의 원인이 되기 때문이다[
22]. 특히 Bare-NCA의 경우, 양극 활물질과 황화물계 고체 전해질이 직접 접촉하면서 전해질이 분해되어 CEI 층이 더 많이 형성되며, 이로 인해 LNO-NCA의 초기 쿨롱 효율은 85.87%로 나타난 반면, Bare-NCA에서는 LNO-NCA보다 6.76% 낮은 79.11%의 초기 쿨롱 효율을 보였다.
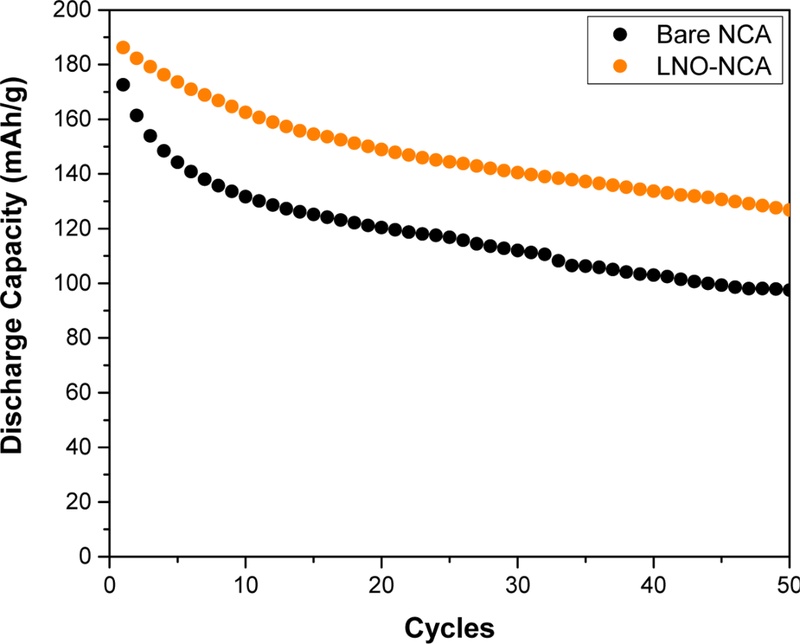
제작된 토크 셀을 활용해 1 C의 C-rate로 50 사이클 동안 충·방전 실험을 진행하였으며, 이를 통해 Bare-NCA와 LNO-NCA의 방전 용량 유지율을 비교하였다.
Fig. 6에 따르면, LNO-NCA는 약 68.1%의 방전 용량 유지율을 보여, 56.5%를 기록한 Bare-NCA보다 약 11.6%가 높게 나타났다. 이러한 차이는 고체 전해질과 양극 활성 물질(CAM) 사이에서 발생하는 전기화학적 부반응에 기인한 것으로 해석된다. 사이클링 과정에서 Bare-NCA의 계면에서는 전기화학적 분해 반응이 활발히 진행되어 리튬 이온 전도성이 낮은 CEI 층이 형성되며, 이는 방전 용량의 급격한 저하로 이어진다[
23]. 반면, LNO 코팅은 이러한 부반응을 효과적으로 억제하여 계면 안정성을 강화하여 결과적으로 방전 용량 유지율을 크게 향상시킨 것으로 판단된다.
Fig. 6Discharge capacity at a C-rate of 1C for 50 charge-discharge cycles
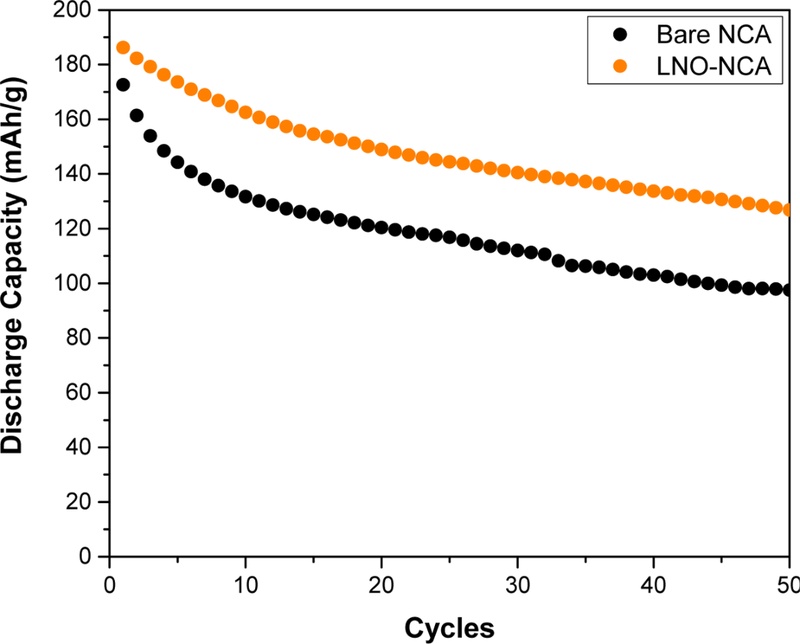
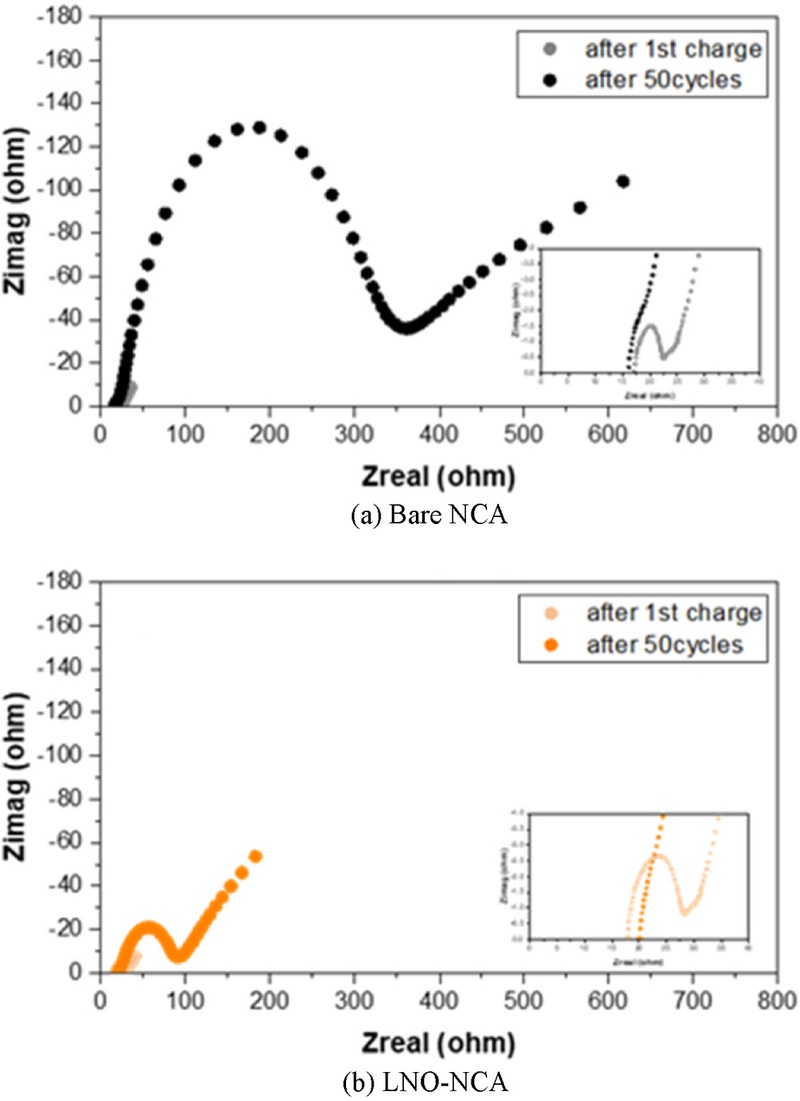
Fig. 7의 EIS Nyquist Plot을 통해, 초기 충전된 셀과 50 사이클 후의 셀에서 저항 변화를 비교하였다. 저주파 영역의 꼬리(Tail) 부분은 Warburg Impedance에 해당하며, 이는 전극 내 리튬 확산과 밀접한 관계가 있음을 시사한다. 반원(Semi-circle) 영역에서는 계면에서의 전하 전달 저항을 확인할 수 있으며, 50 사이클 후 Bare-NCA와 LNO-NCA 간 저항 차이가 더욱 커지는 경향을 보였다.
Fig. 7EIS data after the first charge and 50 cycles of (a) Bare NCA and (b) LNO-NCA
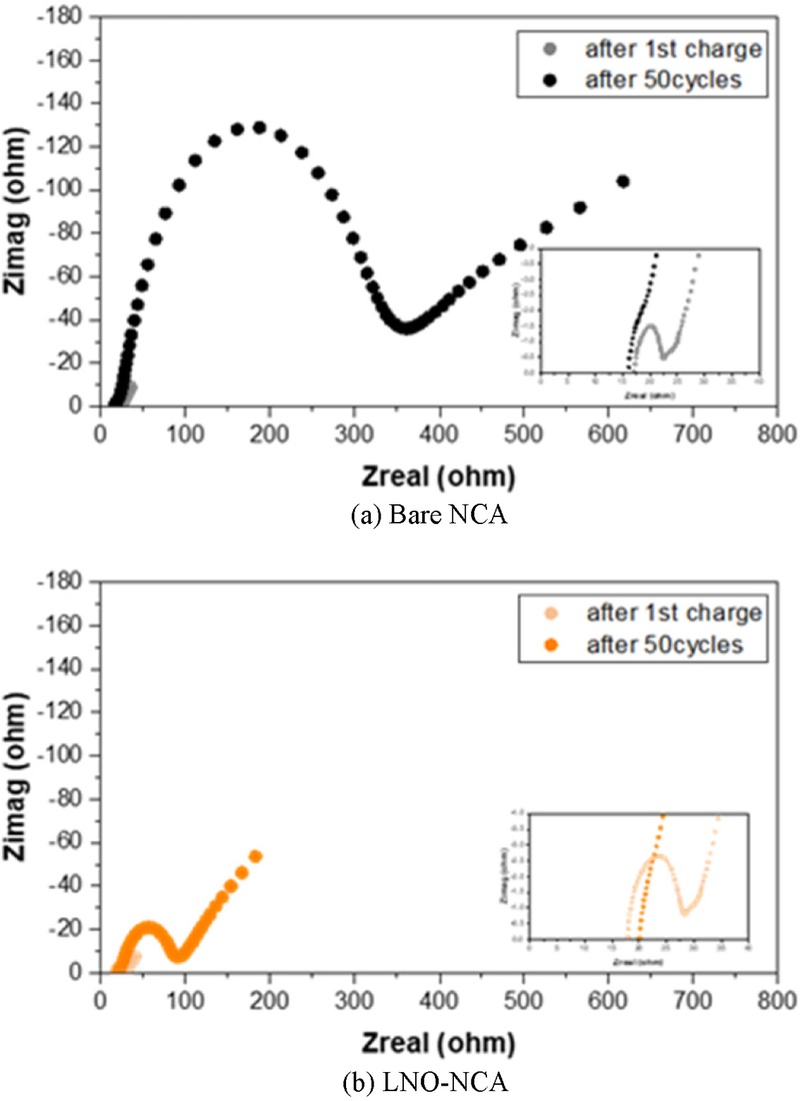
구체적으로, LNO-NCA의 계면 저항은 초기 10.35 Ω에서 71.41 Ω으로 약 6.90배 증가한 반면, Bare-NCA는 5.37 Ω에서 343.77 Ω으로 약 64.02배 증가하였다. Bare가 초기 대비 더 많이 증가한 것을 확인할 수 있다. 이는 전극과 고체 전해질 간 직접적인 접촉으로 인해 고체 전해질이 분해되고, 공간 전하 층(Space Charge Layer)이 형성된 결과로 해석할 수 있다. 반면, 45oC에서 7.379 × 10-8 S/cm의 낮은 이온 전도도를 가지는 Amorphous한 LNO 코팅층은 NCA와 LPSCl 사이의 초기 계면 저항을 증가시키는 원인이 된다. 따라서, 초기 충전 상태에서 Bare-NCA의 계면 저항이 LNO-NCA대비 약 192.74% 감소하였다. 하지만, 50 사이클 후에는 약 481.65% 증가하는 현상이 관찰되었다. 이는 사이클링이 진행됨에 따라 전해질과 양극에서 형성되는 부산물이 이온 전도에 큰 영향을 미친다는 점을 다시 한번 확인해준다. 이러한 변화는 리튬 이온의 계면 수송을 방해하여 저항 증가의 주요 원인으로 작용했으며, 사이클링이 진행될수록 계면 특성이 변화하면서 전하 이동이 더욱 저해되었음을 시사한다.
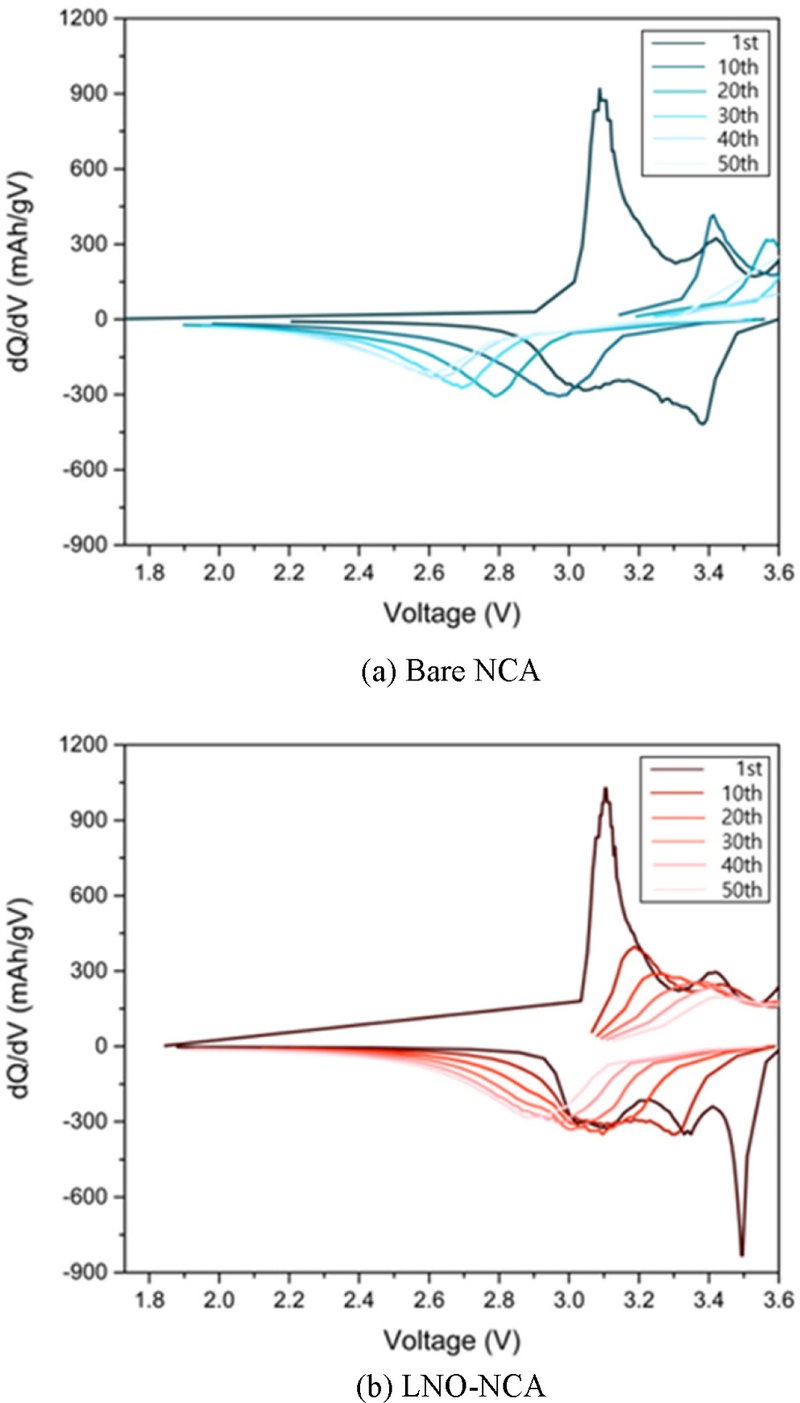
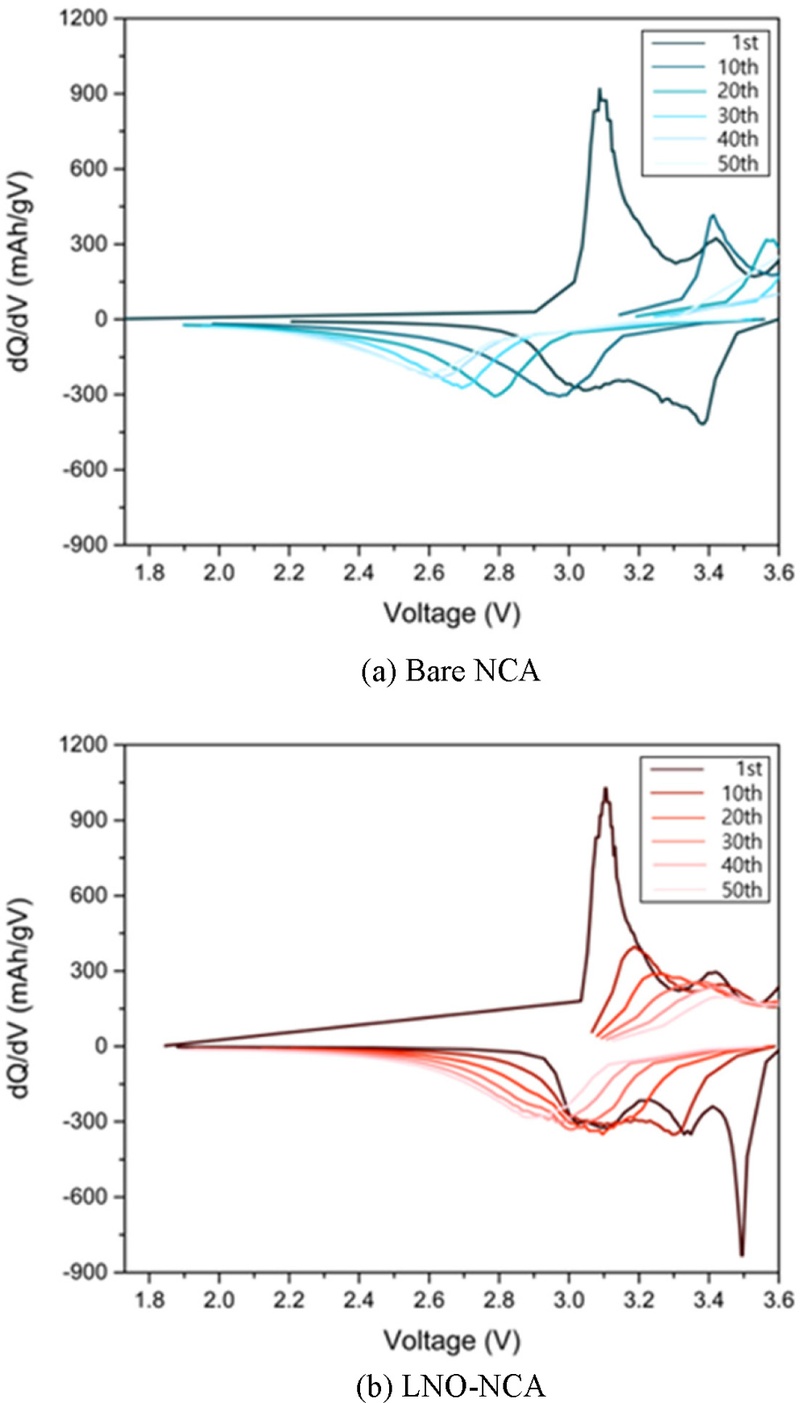
Fig. 8의 dQ/dV 곡선을 통해 사이클링 중 셀의 구조변화를 확인할 수 있었다. 첫 번째 사이클 이후에는 뚜렷한 강도를 가진 피크가 관찰되며, 사이클 횟수가 증가함에 따라 피크의 강도는 점차 감소하는 경향을 보였다. 이는 열화가 진행됨에 따라 전기화학반응에 참여할 수 있는 리튬의 양이 감소하기 때문이다. 또한, 사이클 횟수가 증가할수록 피크가 고전압 영역으로 이동하는 경향을 보였는데, 이는 열화로 인해 셀 내부 저항이 증가하면서 동일한 dQ를 위해 더 큰 전압이 요구되기 때문이다. 특히, Bare-NCA에 비해 LNO-NCA에서는 사이클링이 진행됨에 따라 피크 이동의 감소가 상대적으로 작게 나타났는데, 이는 LNO 코팅층이 사이클 중 구조적 열화를 억제하는 보호층 역할을 했음을 시사한다[
24].
Fig. 8dQ/dV curves after 1, 10, 20, 30, 40, 50 cycles of (a) Bare NCA and (b) LNO-NCA
3.2.2 LNO 코팅이 NCA 양극의 C-rate 특성과 계면 안정성에 미치는 영향
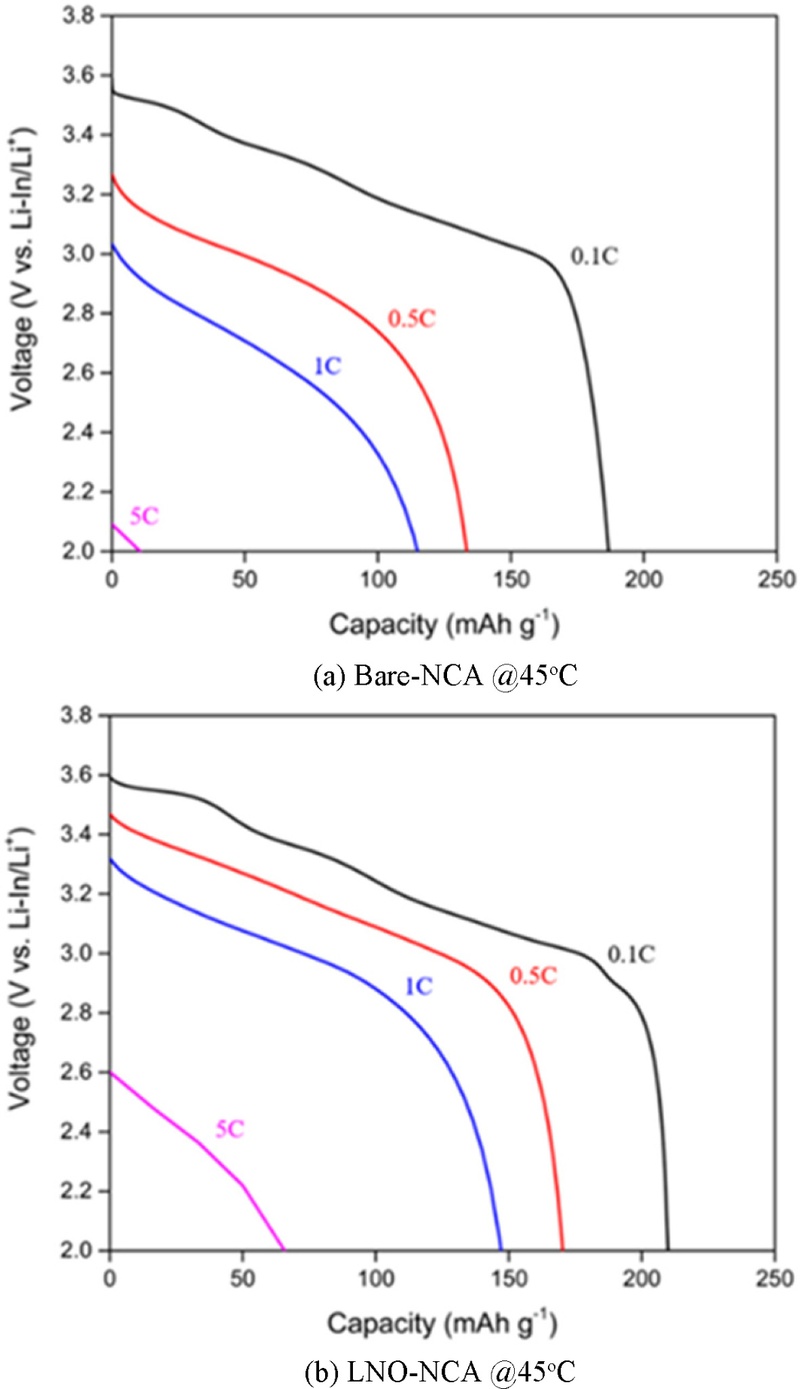
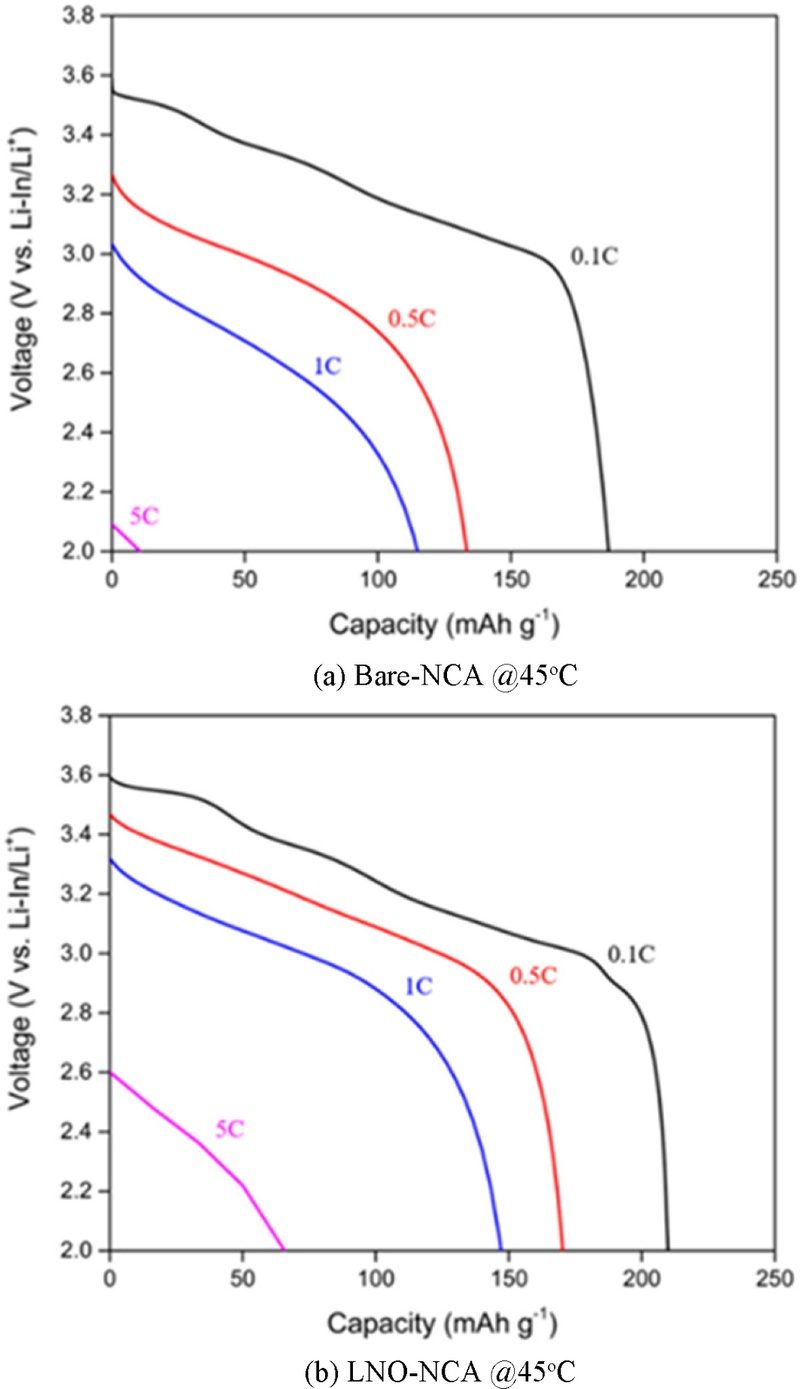
Fig. 9에서는 C-rate에 따른 방전 용량을
Fig. 7과 동일한 조건(45
oC에서 1회 사이클링 후)에서 측정하였다. 충전 시의 C-rate은 0.1 C로 고정하였으며, 방전 시의 C-rate(0.1 C, 0.5 C, 1 C, 5 C)에 따른 방전 용량을 비교하였다. 그래프에서 C-rate이 증가할수록 과전압이 증가한다는 것을 알 수 있고[
25], LNO-NCA의 경우, 각 C-rate에서의 방전 용량은 210.38 mAhg
-1 (0.1 C), 171.24 mAhg
-1 (0.5 C), 148.74 mAhg
-1 (1 C), 72.04 mAhg
-1 (5 C)로 측정되었으며, Bare-NCA의 방전 용량은 각각 184.67 mAhg
-1 (0.1 C), 134.97 mAhg
-1 (0.5 C), 118.01 mAhg
-1 (1 C), 23.64 mAhg
-1 (5 C)로 나타났다. 모든 C-rate에서 LNO-NCA가 더 높은 방전 용량을 나타냈으며, 특히 더 넓은 전압 플래터(Voltage Plateau)를 보였다. 이는 특정 전압에서 방전 과정이 보다 안정적으로 진행됨을 의미한다.
Fig. 9Capacity at a C-rate of 0.1C after 1 cycling
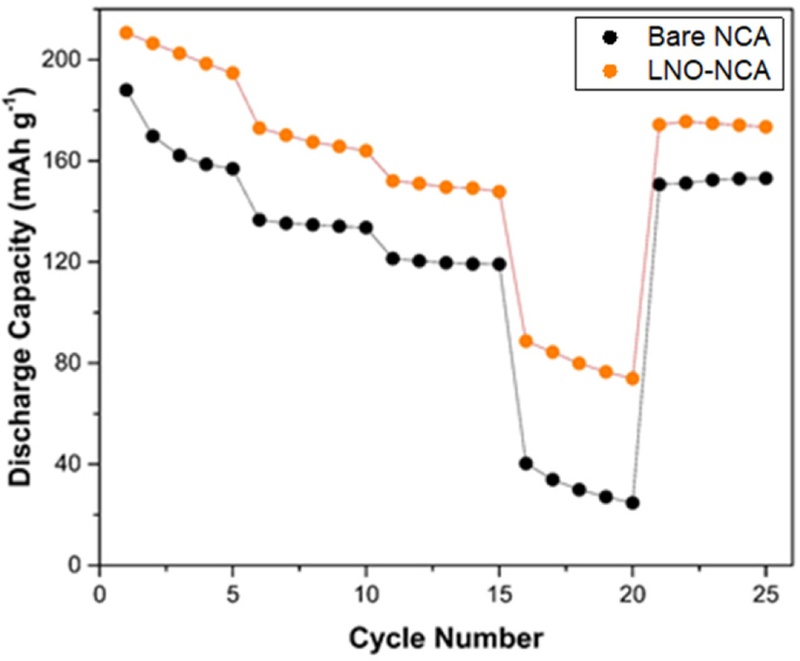
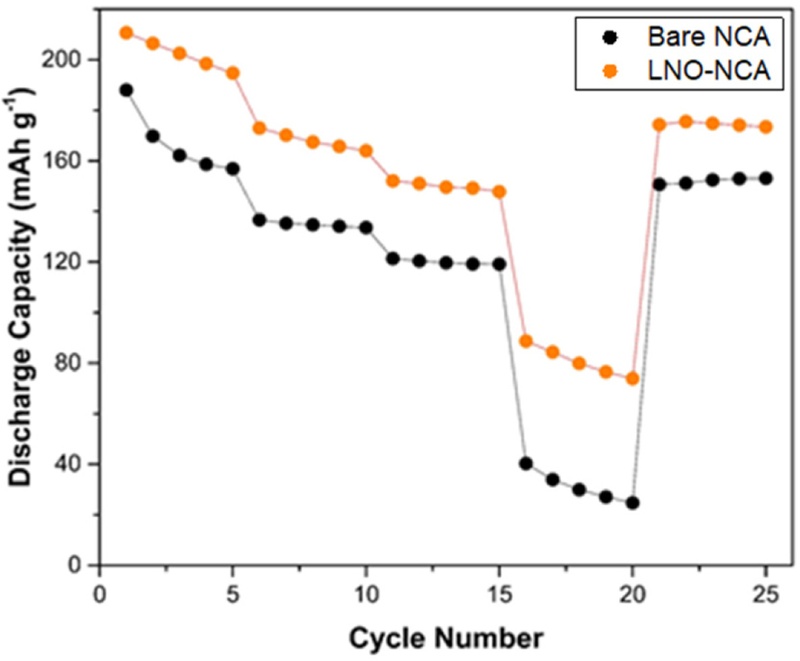
Figs. 10는
9과 동일한 조건에서 방전 속도를 0.1 C에서 5 C까지 변화시키며, 각 조건에서 5회씩 사이클링한 LNO-NCA와 Bare-NCA의 용량 비율(Rate Capability)을 보여준다. Bare-NCA는 높은 방전 속도(5 C)에서 LNO-NCA 80.66 mAhg⁻¹)보다 현저히 낮은 방전 용량 31.20 mAhg
-1)을 보였으며, 1 C에서 5 C로의 사이클링 과정에서 LNO-NCA (46.21%)보다 훨씬 높은 용량 감소율(73.99%)을 나타냈다.
Fig. 10Discharge capacity of (a) Bare-NCA and (b) LNO-NCA according to C-rate
이는 LNO가 비정질(Amorphous) 구조를 유지하면서 보호층으로 작용하여, 사이클이 진행됨에도 불구하고 양극 활물질과 황화물계 고체 전해질 사이에서 안정적인 계면을 형성했기 때문으로 해석된다. 또한, Bare-NCA에서는 전해질 분해로 인해 형성된 절연성 CEI 층이 전극과 전해질 사이의 리튬 이온 교환을 방해하는 반면, LNO-NCA는 높은 방전 속도에서도 충분한 리튬 이온 전도가 가능하여 높은 방전 용량을 유지하는 것으로 판단된다[
26].
4. 결론
이 연구에서는 Particle ALD 방법을 활용하여 양극 활물질인 NCA에 균일한 LNO층을 형성할 수 있었다. XPS, XRD, SEM 분석을 통해 LNO 박막의 증착 거동과 물성을 평가하였다. XPS 분석 결과, NCA 입자 표면에 리튬, 니오븀, 산소로 구성된 LNO 층이 형성되었음을 확인하였으며, XRD 분석을 통해 코팅된 NCA 입자가 비정질(Amorphous) 구조를 유지함을 밝혔다. 또한, SEM-EDS 분석을 통해 O, Al, Co, Ni, Nb 원소가 균일하게 분포되어 있음을 확인하였다. 토크 셀을 제작하여, LNO가 코팅된 LNO-NCA 입자와 LNO가 코팅되지 않은 Bare-NCA 입자의 전기화학적 특성을 비교하였다. 사이클링 동안 방전 용량 및 용량 유지율 모두 LNO-NCA에서 더 높게 나타났으며, 이는 LNO 층이 양극 활물질(CAM)과 황화물계 고체 전해질(SE)의 직접적인 접촉을 방지하여 전하 수송 저항을 감소시켰기 때문이다. 이와 같이, 균일하고 안정적인 코팅층을 형성하는 Particle ALD 기술을 배터리 분야에 적용함으로써 차세대 에너지 저장 장치의 성능을 향상시킬 수 있을 것으로 기대된다. 앞으로도 Particle ALD 공정을 최적화하고, 다양한 양극 활물질 및 전해질 조합에 적용하여 전고체 배터리의 실용화를 앞당기는 연구가 지속적으로 이루어질 필요가 있다.
ACKNOWLEDGMENTS
이 연구는 2021년도 정부(산업통상자원부)의 재원으로 한국에너지기술평가원의 지원을 받아 수행된 연구임(No. 20213030030190, 연료전지 시스템의 스마트설계∙제조∙운전 오픈 플랫폼 개발).
REFERENCES
- 1.
Xiao, Y., Wang, Y., Bo, S.-H., Kim, J. C., Miara, L. J., Ceder, G., (2020), Understanding interface stability in solid-state batteries, Nature Reviews Materials, 5(2), 105-126.
10.1038/s41578-019-0157-5
- 2.
Li, C., Wang, Z.-Y., He, Z.-J., Li, Y.-J., Mao, J., Dai, K.-H., Yan, C., Zheng, J.-C., (2021), An advance review of solid-state battery: Challenges, progress and prospects, Sustainable Materials and Technologies, 29, e00297.
10.1016/j.susmat.2021.e00297
- 3.
Richards, W. D., Miara, L. J., Wang, Y., Kim, J. C., Ceder, G., (2016), Interface stability in solid-state batteries, Chemistry of Materials, 28(1), 266-273.
10.1021/acs.chemmater.5b04082
- 4.
Fu, Z. H., Chen, X., Zhang, Q., (2023), Review on the lithium transport mechanism in solid‐state battery materials, Wiley Interdisciplinary Reviews: Computational Molecular Science, 13(1), e1621.
10.1002/wcms.1621
- 5.
Lee, K.-S., Bang, H.-J., Sun, Y.-K., (2007), Electrochemical properties of spinel Limn2O4 prepared through different synthesis routes, Journal of the Korean Electrochemical Society, 10(1), 48-51.
10.5229/JKES.2007.10.1.048
- 6.
Fergus, J. W., (2010), Recent developments in cathode materials for lithium ion batteries, Journal of Power Sources, 195(4), 939-954.
10.1016/j.jpowsour.2009.08.089
- 7.
Wang, B., Zhang, F.-L., Zhou, X.-A., Wang, P., Wang, J., Ding, H., Dong, H., Liang, W.-B., Zhang, N.-S., Li, S.-Y., (2021), Which of the nickel-rich NCM and NCA is structurally superior as a cathode material for lithium-ion batteries?, Journal of Materials Chemistry A, 9(23), 13540-13551.
10.1039/D1TA01128F
- 8.
Agrawal, R., Pandey, G., (2008) , Solid polymer electrolytes: Materials designing and all-solid-state battery applications: An overview, Journal of Physics D: Applied Physics, 41(22), 223001.
10.1088/0022-3727/41/22/223001
- 9.
Chen, R., Li, Q., Yu, X., Chen, L., Li, H., (2019), Approaching practically accessible solid-state batteries: Stability issues related to solid electrolytes and interfaces, Chemical Reviews, 120(14), 6820-6877.
10.1021/acs.chemrev.9b00268
- 10.
Zhang, Q., Cao, D., Ma, Y., Natan, A., Aurora, P., Zhu, H., (2019), Sulfide‐based solid‐state electrolytes: Synthesis, stability, and potential for all‐solid‐state batteries, Advanced Materials, 31(44), 1901131.
10.1002/adma.201901131
- 11.
Wu, J., Liu, S., Han, F., Yao, X., Wang, C., (2021), Lithium/sulfide all‐solid‐state batteries using sulfide electrolytes, Advanced Materials, 33(6), 2000751.
10.1002/adma.202000751
- 12.
Yang, H., Ku, M., Kim, J., Lee, D., Lee, H., Kim, Y.-B., (2022), Conformal buffer layer coating on ni-rich cathode powder via particle atomic layer deposition for all-solid-state batteries, ACS Applied Energy Materials, 5(7), 8313-8323.
10.1021/acsaem.2c00867
- 13.
Xiao, Y., Miara, L. J., Wang, Y., Ceder, G., (2019), Computational screening of cathode coatings for solid-state batteries, Joule, 3(5), 1252-1275.
10.1016/j.joule.2019.02.006
- 14.
Paek, J. Y., Chang, I., Park, J. H., Ji, S., Cha, S. W., (2014), A study on properties of yttrium-stabilized zirconia thin films fabricated by different deposition techniques, Renewable Energy, 65, 202-206.
10.1016/j.renene.2013.08.043
- 15.
Kim, A.-Y., Strauss, F., Bartsch, T., Teo, J. H., Janek, J., Brezesinski, T., (2021), Effect of surface carbonates on the cyclability of LiNbO3-coated NCM622 in all-solid-state batteries with lithium thiophosphate electrolytes, Scientific Reports, 11(1), 5367.
10.1038/s41598-021-84799-1
- 16.
Yang B. C., Shin J. W.,, Kwon H.-D., An J., (2017), The properties of ZrO2 film deposition by ALD at low temperature, Journal of the Korean Society for Precision Engineering, 34(10), 735-738.
10.7736/KSPE.2017.34.10.735
- 17.
Sneh, O., Clark-Phelps, R. B., Londergan, A. R., Winkler, J., Seidel, T. E., (2002), Thin film atomic layer deposition equipment for semiconductor processing, Thin Solid Films, 402(1-2), 248-261.
10.1016/S0040-6090(01)01678-9
- 18.
Korin, E., Froumin, N., Cohen, S., (2017), Surface analysis of nanocomplexes by x-ray photoelectron spectroscopy (XPS), ACS Biomaterials Science & Engineering, 3(6), 882-889.
10.1021/acsbiomaterials.7b00040
- 19.
Khan, H., Yerramilli, A. S., D'Oliveira, A., Alford, T. L., Boffito, D. C., Patience, G. S., (2020), Experimental methods in chemical engineering: X‐ray diffraction spectroscopy—XRD, The Canadian Journal of Chemical Engineering, 98(6), 1255-1266.
10.1002/cjce.23747
- 20.
Kang, B., Hong, S., Yoon, H., Kim, D., Kim, C., (2018), Stabilization of nickel-rich layered cathode materials of high energy density by Ca doping, Korean Journal of Materials Research, 28(5), 273-278.
10.3740/MRSK.2018.28.5.273
- 21.
Welzel, U., Ligot, J., Lamparter, P., Vermeulen, A., Mittemeijer, E., (2005), Stress analysis of polycrystalline thin films and surface regions by X-ray diffraction, Applied Crystallography, 38(1), 1-29.
10.1107/S0021889804029516
- 22.
Wang, Z., Ma, J., Zhang, L., (2017), State-of-health estimation for lithium-ion batteries based on the multi-island genetic algorithm and the gaussian process regression, IEEE Access, 5, 21286-21295.
10.1109/ACCESS.2017.2759094
- 23.
Cheng, Z., Liu, M., Ganapathy, S., Li, C., Li, Z., Zhang, X., He, P., Zhou, H., Wagemaker, M., (2020), Revealing the impact of space-charge layers on the Li-ion transport in all-solid-state batteries, Joule, 4(6), 1311-1323.
10.1016/j.joule.2020.04.002
- 24.
Onoue, K., Nasu, A., Matsumoto, K., Hagiwara, R., Kobayashi, H., Matsui, M., (2023), Trigger of the highly resistive layer formation at the cathode-electrolyte interface in all-solid-state lithium batteries using a garnet-type lithium-ion conductor, ACS Applied Materials & Interfaces, 15(45), 52333-52341.
10.1021/acsami.3c07177
- 25.
Zhao, W., Zhang, R., Ren, F., Karger, L., Dreyer, S. r. L., Lin, J., Ma, Y., Cheng, Y., Pal, A. S., Velazquez-Rizo, M., (2025), Protective coating of single-crystalline Ni-Rich cathode enables fast charging in all-solid-state batteries, ACS Nano, 19(9), 8595-8607.
10.1021/acsnano.4c14322
- 26.
Negi, R. S., Yusim, Y., Pan, R., Ahmed, S., Volz, K., Takata, R., Schmidt, F., Henss, A., Elm, M. T., (2022), A dry-processed Al2O3/LiAlO2 coating for stabilizing the cathode/electrolyte interface in high-ni NCM-based all-solid-state batteries, Advanced Materials Interfaces, 9(8), 2101428.
10.1002/admi.202101428
Biography
- Min-ji Kim
Ph.D. candidate in the Department of Mechanical Convergence Engineering, Hanyang University. Her research is about the electrode fabrication and interface of all solid batteries.
- In-suk Song
M.S. student in the Department of Mechanical Engineering in the Department of Mechanical Engineering, Hanyang University. His research interest is all solid state batteries
- Hyo-jun Ahn
M.S. student in the Department of Mechanical Engineering in the Department of Mechanical Engineering, Hanyang University. His research interest is all solid state batteries
- Sun-min Kim
Ph.D. candidate in the Department of Mechanical Convergence Engineering, Hanyang University. His research is about the electrode fabrication and interface of all solid batteries
- Young-Beom Kim
Professor in the Department of Mechanical Convergence Engineering, Hanyang University. His research interests include development of various solid-state energy conversion devices including solid oxide fuel cells, all-solid-state batteries etc.